ADCIRCA, INN-tadalafil - EMA

EMA/475361/2015
EMEA/H/C/001021
Résumé EPAR à l’intention du public
Adcirca1
tadalafil
Ce document est un résumé du rapport européen public d'évaluation (EPAR) relatif à Adcirca. Il
explique de quelle manière l’évaluation du médicament à laquelle le comité des médicaments à usage
humain (CHMP) a procédé l’a conduit à rendre un avis favorable à l'octroi d'une autorisation de mise
sur le marché et à établir ses recommandations relatives aux conditions d’utilisation de Adcirca.
Qu’est-ce qu'Adcirca?
Adcirca est un médicament dont le principe actif est le tadalafil. Il est disponible sous la forme de
comprimés (20 mg).
Dans quel cas Adcirca est-il utilisé?
Adcirca est utilisé pour le traitement des adultes souffrant d’hypertension artérielle pulmonaire (HTAP)
afin d’améliorer leur capacité d'effort (aptitude à exercer une activité physique). L'HTAP est une
pression sanguine anormalement élevée dans les artères des poumons. Adcirca est indiqué chez les
patients présentant la classe II ou III de la maladie. La «classe» reflète la gravité de la maladie: la
«classe II» implique une limitation légère de l'activité physique, et la «classe III» une limitation
prononcée. Adcirca s’est avéré efficace contre l’HTAP non liée à une cause identifiée et contre l’HTAP
causée par une maladie vasculaire liée au collagène.
Le médicament n'est délivré que sur ordonnance.
Comment Adcirca est-il utilisé?
Le traitement par Adcirca ne doit être instauré et suivi que par un médecin ayant l’expérience de la
prise en charge de l’HTAP.
1 Précédemment connu sous l’appellation Tadalafil Lilly
30 Churchill Place ● Canary Wharf ● London E14 5EU ● United Kingdom An agency of the European
Union
Telephone +44 (0)20 3660 6000 Facsimile +44 (0)20 3660 5555
Send a question via our website www.ema.europa.eu/contact
© European Medicines Agency, 2015. Reproduction is authorised provided the source is acknowledged.

Adcirca est administré en deux comprimés (40 mg) une fois par jour, pendant ou en dehors des repas.
La dose de départ doit être réduite chez les patients présentant des troubles légers à modérés des
reins ou du foie, mais elle peut être augmentée si nécessaire en fonction de la réponse du patient.
Adcirca est déconseillé chez les patients présentant des troubles sévères des reins ou du foie.
Comment Adcirca agit-il?
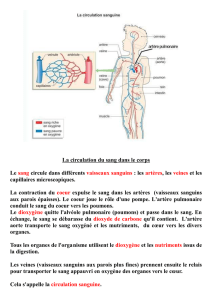
L’HTAP est une maladie débilitante qui se traduit par une constriction (rétrécissement) grave des
vaisseaux sanguins des poumons. Elle provoque une pression sanguine élevée dans les vaisseaux
acheminant le sang du cœur vers les poumons. La pression diminue la quantité d’oxygène pouvant
pénétrer dans le sang dans les poumons, ce qui rend l’activité physique plus difficile. Le principe actif
d’Adcirca, le tadalafil, appartient à une catégorie de médicaments appelés «inhibiteurs de la
phosphodiestérase de type 5 (PDE5)», ce qui signifie qu’il bloque l’enzyme PDE5. Cette enzyme se
trouve dans les vaisseaux sanguins des poumons. Lorsque l’enzyme est bloquée, une substance
appelée «guanosine monophosphate cyclique (GMPc)», qui ne peut plus être dégradée, reste dans les
vaisseaux où elle induit un relâchement et un élargissement des vaisseaux sanguins. Chez les patients
atteints d’HTAP, Adcirca provoque un élargissement des vaisseaux sanguins des poumons, diminuant
ainsi la pression sanguine et atténuant les symptômes.
Quelles études ont été menées sur Adcirca?
Quatre dosages d’Adcirca (2,5; 10; 20 et 40 mg une fois par jour) ont été comparés à un placebo
(traitement fictif) dans le cadre d’une étude principale portant sur 406 patients atteints d’HTAP, la
plupart présentant une classe II ou III de la maladie, de cause inconnue ou provoquée par une maladie
vasculaire liée au collagène. Le principal critère d’évaluation de l’efficacité était l’évolution de la
capacité d’effort (l’aptitude à exercer une activité physique) mesurée par la distance que les patients
étaient capables de parcourir en six minutes après 16 semaines de traitement.
Quel est le bénéfice démontré par Adcirca au cours des études?
Adcirca s’est avéré plus efficace que le placebo dans l’amélioration de la capacité d’effort. Avant le
traitement, les patients pouvaient parcourir environ 343 mètres en six minutes. Après 16 semaines,
cette distance avait augmenté de 26 m supplémentaires chez les patients prenant 40 mg d’Adcirca, par
rapport aux patients sous placebo.
Quel est le risque associé à l’utilisation d’Adcirca?
Les effets indésirables les plus couramment observés sous Adcirca (chez plus d’un patient sur 10) sont
les suivants: maux de tête, bouffées vasomotrices (rougeurs), rhinopharyngite (inflammation du nez et
de la gorge) y compris nez bouché ou qui coule et obstruction des sinus, nausées (sensation de
malaise), dyspepsie (brûlures d’estomac) notamment douleurs à l’estomac, myalgie (douleurs
musculaires), douleurs lombaires et dans les extrémités (bras, mains, jambes ou pieds).
Adcirca ne doit pas être utilisé chez les patients ayant subi un infarctus du myocarde aigu (crise
cardiaque soudaine) dans les trois derniers mois, ou qui présentent une hypotension (faible pression
artérielle) sévère. Adcirca ne doit pas être administré avec des nitrates (groupe de médicaments
utilisés pour soigner l’angine) ni avec des médicaments de la classe des «stimulateurs de la guanylate
cyclase» tels que le riociguat (un autre médicament pour le traitement de l'hypertension pulmonaire).
Il ne doit pas non plus être utilisé chez les patients qui ont subi une perte de la vision en raison d’un
Adcirca0F
EMA/475361/2015 Page 2/3

problème appelé «neuropathie optique ischémique antérieure non artéritique (NOIAN)», qui affecte
l’afflux sanguin vers le nerf optique.
Pour une description complète des effets indésirables et des restrictions associés à Adcirca, voir la
notice.
Pourquoi Adcirca a-t-il été approuvé?
Le CHMP a estimé que les bénéfices d’Adcirca sont supérieurs à ses risques et a recommandé l’octroi
d'une autorisation de mise sur le marché pour ce médicament.
Quelles sont les mesures prises pour assurer l'utilisation sûre et efficace
d'Adcirca?
Un plan de gestion des risques a été élaboré pour s'assurer qu'Adcirca est utilisé d'une manière aussi
sûre que possible. Sur la base de ce plan, des informations de sécurité ont été incluses dans le résumé
des caractéristiques du produit et dans la notice d'Adcirca, y compris les précautions à observer par les
professionnels des soins de santé et les patients.
Autres informations relatives à Adcirca
La Commission européenne a délivré une autorisation de mise sur le marché valide dans toute l’Union
européenne pour Tadalafil Lilly, le 1er octobre 2008. Cette autorisation était fondée sur l’autorisation
délivrée pour Cialis en 2002 («consentement éclairé»). Ce médicament a changé de nom le 21 octobre
2009 et s’appelle désormais Adcirca.
L’EPAR complet relatif à Adcirca est disponible sur le site web de l’Agence, sous: ema.europa.eu/Find
medicine/Human medicines/European public assessment reports. Pour plus d’informations sur le
traitement par Adcirca, veuillez consulter la notice (également comprise dans l’EPAR) ou contacter
votre médecin ou votre pharmacien.
Dernière mise à jour du présent résumé: 07-2015.
Adcirca0F
EMA/475361/2015 Page 3/3
1
/
3
100%