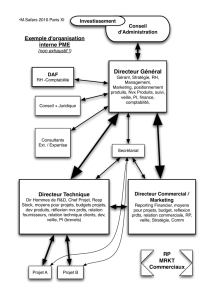
Ch. B10. Le développement d`un organisme

Biologie – Chapitre B10. Le développement d'un organisme animal
Ch. B10. Le développement d'un organisme animal
Partie du programme traitée : II-D-2. Développement d'un organisme animal
I. Développement embryonnaire et acquisition du plan d'organisation
chez les amphibiens
1. La fécondation forme un embryon à symétrie bilatérale
a) L'ovocyte est polarisé
b) Fécondation et réaction corticale
c) La rotation corticale
d) Rotation corticale et axe dorso-ventral
2. La segmentation conduit à une blastula
a) La segmentation est dissymétrique
b) De la morula à la blastula
c) Les feuillets existent, mais n'ont pas leur place définitive
3. La gastrulation met en place les feuillets
a) Les mouvements gastruléens
i. Suivi des mouvements
ii. Internalisation de l'endoderme et du mésoderme
b) Mécanismes cellulaires impliqués dans la gastrulation
i. Cellules en bouteille
ii. Epibolie de l'ectoderme
iii. Convergence et extension du mésoderme et de l'endoderme
iv. Migration du mésoderme sur le toit du blastocœle
c) La gastrulation est une étape critique du développement
4. La neurulation met en place le tube neural
a) Formation et invagination de la plaque neurale
b) Mécanismes cellulaires impliqués dans la neurulation
5. L'organogenèse achève le développement embryonnaire
II. Contrôle du développement embryonnaire
1. Les inductions déterminent l'axe dorso-ventral
a) L'induction du mésoderme
i. Territoires présomptifs et déterminés diffèrent (Nieuwkoop)
ii. Les blastomères végétatifs induisent un mésoderme régionalisé (Dale et Slack)
iii. Le centre de Nieuwkoop induit le mésoderme dorsal (Gimlich et Gerhart)
b) Principe de l'induction
i. Un inducteur exerce son action sur une cellule compétente
ii. Un facteur inducteur est une molécule diffusible
c) Inductions, mouvements cellulaires et tissulaires, et expression génétique
i. Signalisation intercellulaire et transduction intracellulaire
ii. Rotation corticale et répartition des déterminants cytoplasmiques
iii. Induction et expression génétique
iv. Mouvements cellulaires et induction
2. La polarité antéro-postérieure est sous le contrôle des gène Hox
BCPST1 – Lycée Châtelet – Douai – Joseph NICOLAS

Biologie – Chapitre B10. Le développement d'un organisme animal
a) Les complexes Hox
b) Les gènes Hox ont une expression spatio-temporelle antéro-postérieure
c) Les gènes Hox contrôlent l'identité antéro-postérieure de l'embryon
3. La différenciation cellulaire
a) Cellule différenciée et indifférenciée
b) Du myoblaste à la cellule musculaire
c) Des cascades d'induction permettent la différentiation de la CMSS
Document 1: Structure générale (haut) du gamète femelle du xénope. Détail du
pole animal (en bas à gauche) et du pôle végétatif (en bas à droite). D'après
Introd. à la biol. du dev., Darribère, 2002.
Document 2: Vue de dessus
d'ovocytes de xénope non
fécondés (haut) et fécondés
(bas). D'après Univ. Paris VI.
Document 3: Rotation corticale
microtubules-dépendante et
point d'entrée du spermatozoïde.
D'après Introd. à la biol. du dev.,
Darribère, 2002.
BCPST1 – Lycée Châtelet – Douai – Joseph NICOLAS

Biologie – Chapitre B10. Le développement d'un organisme animal
Document 4: Importance du croissant
gris dans la dorsalisation de l'embryon.
La première mitose est toujours selon
l'axe PA-PV, mais peut selon les cas
couper le croissant gris en deux ou
non. Seuls les embryons possédant une
portion de croissant gris ont une
symétrie dorso-ventrale. D'après
Introd. à la biol. du dev., Darribère,
2002.
Document 5: Cycle de développement d'une grenouille (anoure). D'après
Introd. à la biol. du dev., Darribère, 2002.
Document 6: Les étapes de la segmentation, d'après Biol. du
dév., Le Moigne et Foucrier, 2009.
Document 7: Expérience de Nieuwkoop
BCPST1 – Lycée Châtelet – Douai – Joseph NICOLAS

Biologie – Chapitre B10. Le développement d'un organisme animal
Document 8:
Vues au MEB de
gastrulas en
coupe (en haut)
ou de l'extérieur
(en bas). De
gauche à droite :
stade encoche du
blastopore (début
de gastrulation) ;
stade du fer à
cheval ; stade du
bouchon vitellin ;
stade de la fente
blastoporale.
D'après Introd. à
la biol. du dev.,
Darribère, 2002. Document 9: Différentes représentations des mouvements
morphogénétiques de la gastrulation. A : mouvements
d'épibolie. B : fermeture de l'archentéron. C et D : deux vues
internes de la gastrulation, l'ectoderme ayant été retiré
virtuellement (stade bouchon vitellin). D'après Biol. du dév.,
Le Moigne et Foucrier, 2009.
Document 10: Vue dorsale (haut) et coupe sagittale
(bas) de différentes phases de la gastrulation (de A à
F). Les traces noires (en haut comme en bas)
représentent les marques colorées qui ont été
placées par Vogt afin de suivre les mouvements.
D'après Biol. du dév., Le Moigne et Foucrier, 2009.
Document 11: Intercalation radiale et latérale dans deux
zones de la gastrula. D'après Introd. à la biol. du dev.,
Darribère, 2002.
BCPST1 – Lycée Châtelet – Douai – Joseph NICOLAS

Biologie – Chapitre B10. Le développement d'un organisme animal
Document 12: Mise en évidence de l'importance des
interactions entre la MEC du toit du blastocœle et les
cellules du mésoderme. Haut : sur une gastrula
jeune, on découpe une portion de la calotte animale,
et on la retourne. La gastrulation s'arrête. L'analyse
au MEB montre que les cellules du mésoderme
évitent la région dépourvue de MEC. Bas : chez une
gastrula jeune, on injecte dans le blastocœle un
anticorps anti-fibronectine. La gastrulation s'arrête
et forme une exogastrula (pas d'invagination, alors
que l'épibolie est tout à fait normale. D'après Introd.
à la biol. du dev., Darribère, 2002.
Document 13: Structure
des cellules du mésoderme
en interaction avec la MEC
du toit du blastocœle.
Haut : vues au MEB ; bas :
interprétation en terme de
mouvements cellulaires et
d'interactions cellule-MEC.
D'après Introd. à la biol.
du dev., Darribère, 2002.
Document 14: Importance des microtubules et des
filaments d'actine dans la morphologie des
cellules en bouteille. D'après Introd. à la biol. du
dev., Darribère, 2002.
BCPST1 – Lycée Châtelet – Douai – Joseph NICOLAS
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
1
/
15
100%