Correction du DS 2

1
Correction du DS 2 :
Exercice 1 :
A. Étude du fonctionnement d’un spectrophotomètre.
1. Étude du réseau
1.1.1.(0,5) Lorsque la lumière traverse une fente de petite largeur on observe un phénomène de
diffraction.
La lumière ne se propage plus en ligne droite.
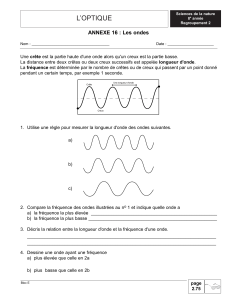
1.1.2. (0,5)
a
où la longueur d'onde et la largeur a de la fente s’expriment en mètres (m).
L’écart angulaire s’exprime en radians (rad).
1.1.3. (0,75) Dans le triangle (OAB), tan =
L
2
D
.
LD
2
or
=a
donc
=D.
L
2a
soit L = =
..2D
a
1.1.4. (0,5) L =
,
9
6
2 500 10 2 0
100 10
= 2,0×10-2 m = 2,0 cm
1.1.5. (0,75) Au centre les différentes taches provoquées par les différentes radiations colorées se
superposent : on observe une tache centrale blanche. Sur les bords les taches des différentes radiations
n’ayant pas la même largeur L, elles ne se superposent pas mais se juxtaposent, on observe des irisations.
1.2. (0,5) La radiation la plus déviée est celle de longueur d’onde la plus élevée. Elle possède une couleur
rouge .
2.Étude du prisme
(1) On a sin i2 =
.sin
air 1
ni
n
D’après l’énoncé : nR < nB donc
ainsi
.sin .sin
air 1 air 1
RB
n i n i
nn
d’où
2R 2B
sin i >sin i
La fonction sinus est croissante sur l’intervalle
2
0 i 90
donc
2R 2B
i > i
L’angle de réfraction est le plus grand pour la radiation rouge.
B. Suivi cinétique par spectrophotométrie d’une transformation chimique
1. Dilution de la solution d’iodure de potassium.
(1,5 ) Soit V le volume de solution 1 à préparer.
Au cours de la dilution, il y a conservation de la quantité de soluté : n0= n1 C0V0=C1V
on a
donc
ainsi V = 5 V0.
Pour préparer la solution on doit utiliser une fiole jaugée d’un volume 5 fois plus grand que la pipette
jaugée. On doit donc choisir la pipette jaugée de V0= 20,0mL et la fiole jaugée de V = 100,0mL
L
O
A
B

2
2. Relation entre l’absorbance A et la concentration en diiode [I2]
1.1. (0,5)
Équation de la réaction
S2O82(aq) + 2 I(aq) = 2 SO42-(aq) + I2(aq)
Instant
Avancement
Quantités de matière en mol
Initial
x=0
n2 = C2.V2
n1 = C1.V1
0
0
Intermédiaire
x
n2 - x
n1 – 2x
2x
x
final
xmax
n2 – xmax
n1 – 2xmax
2xmax
xmax
1.2. (1,5) Si l’ion peroxodisulfate est le réactif limitant, alors n2 – x2max = 0 n2 = x2max
x 2max =C2xV2 = 2,0.10-1x 1,0.10-3 = 2,0.10-4 mol.
Si l’ion iodure est le réactif limitant, alors n1 – 2x1max = 0
X1max= n1/2=
mol
X1max‹ x2max donc l’ion iodure est le réatif limitant et xmax = mol
1.3. (0.75) [I2(aq)]finale =
= 5,0×10-3 mol.L-1
1.4. (0.75) Au bout d’une durée suffisante, la transformation est terminée, on lit alors graphiquement sur la
courbe A=f(t) la valeur de Afinale = 1 on a k =
()2 aq finale
A
I
=
-
,3
1
5 0 10
= 2,0102 mol-1.L
2. Relation entre l’absorbance et l’avancement de la réaction x
2.1. (0.75) D’après la loi de Beer-Lambert A(t) = k.[I2(aq)](t) or [I2(aq)](t) =
donc A(t) = k .
Finalement x(t) = V1 + V2
k x A(t)
2.2. (0.5) V1 + V2
k =
,,
,
3
2
10 10 10
2 0 10
=1,010-5 mol
Sur l’axe des ordonnées on lit xfinal = 0,01 , de plus Afinale = 1 x(tfinale) = V1 + V2
k.A(tfinale) =1,0×105 mol × 1,0 =
0,01 mmol L’unité de l’avancement x sur l’axe des ordonnées est la milli mole.
3. Étude de la vitesse volumique de réaction
3.1. (0.5) vR.=
1dx
.
V dt
avec V volume du milieu réactionnel (considéré constant, ici V = V2 + V2) et x
l’avancement de la réaction en mol.
3.2. (1) La vitesse volumique à la date t est proportionnelle au coefficient directeur de la tangente à la
courbe x= f(t) à cette date. Or ces coefficients directeurs diminuent au cours du temps (la tangente se
rapproche de l’horizontale) :
donc vR1vR2 la vitesse volumique de réaction diminue au
cours du temps.
3.3. (0.5) La concentration des réactifs diminue au cours du temps, les chocs entre les molécules sont de
moins en moins nombreux et donc la vitesse diminue.
3.4. (0.75) t1/2 correspond à la durée au bout de laquelle x(t1/2) = xfinal/ 2.
Graphiquement on mesure t1/2 = 300 s.

3
Exercice 2 :
1. Simulation d’un théâtre à l’aide d’une maquette.
1.1. 0,25 pt. La longueur d’onde est la distance parcourue par une onde périodique pendant une durée égale à
une période T.
1.2. 0,25 pt.
vT
= .f donc
v
f
1.3. 0,5 pt. D’après le texte, la célérité des ultrasons vUS est égale à celle des sons de la voix vSon.
Son
Son Son
v
f
et
Son
US US
vf
Et les fréquences des sons audibles sont telles que 20 Hz < fson < 20 × 103 Hz, tandis que fréquence des ultrasons :
fUS > 2010 3 Hz.
fUS > fSon donc US < Son.
Ainsi la longueur d’onde des ultrasons est inférieure à la longueur d’onde moyenne des sons de la voix.
1.4. 0,25 pt. Les dimensions de la maquette du théâtre sont réduites. Il faut alors que les longueurs d’onde des sons
utilisés soient réduites du même facteur. On a montré que US < Son d’où l’utilisation pratique des ultrasons.
1.5. 0,25 pt. Un milieu est dispersif si la célérité des ondes qui s’y propagent dépend de la fréquence.
1.6. 0,5 pt. Alors que fUS > fSon, la célérité des ondes ultrasonores dans l’air est égale à celle des ondes sonores
(340 m.s1) : l’air n’est donc pas un milieu dispersif pour les ondes sonores et ultrasonores.
2. Rôle du mur : simulation à l’aide d’une cuve à onde
2.1. 0,5 pt. Les ondes créées à la surface de l’eau sont transversales car la direction de la perturbation (verticale) est
perpendiculaire à la direction de propagation de l’onde (horizontale).
2.2. 0,5 pt. Les vaguelettes à la surface de la cuve sont moins visibles lors de l’expérience 1 (mur plan) que lors de
l’expérience 2 (mur plan alvéolé). On peut penser qu’elles possèdent une plus faible amplitude. Ainsi, l’intensité des
ondes sonores reçues par les spectateurs dans les gradins, est plus faible avec un mur plan qu’avec un mur alvéolé.
2.3. 0,25 pt. Le pulpitum est alvéolé du coté de l’orchestre grâce à la présence des niches et des colonnes. Le son de
l’orchestre n’est pas amorti par le pulpitum. (= expérience 2 où le vibreur est équivalent à l’orchestre)
Du coté de la scène, le pulpitum est plan. Dès lors, les sons de l’orchestre réfléchis par le mur situé derrière la scène
sont amortis par la face plane du pulpitum (= expérience 1).
x(t1/2) = 0,005
xfinal =
t1/2
t1
t2

4
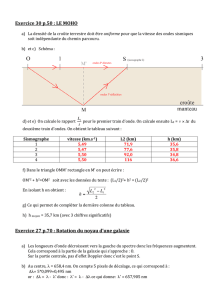
2.4. 0,75 pt. L’échelle du document est : 10 cm en réalité sont représentés par un segment de 1,75 cm.
On en déduit que 7 réel = 10 cm.
réel = 10 / 7 1,4 cm.
2.5. 0,75 pt. Célérité des ondes :
vT
= 1,4 x 10–2
0,14 = 1,0 x 10–1 m.s–1.
2.6. 0,5 pt. Sur le schéma, la largeur de l’ouverture est du même ordre de grandeur que la longueur d’onde, il se
produit une diffraction de façon visible. Ce phénomène ne modifie pas la longueur d’onde, la fente se comporte
comme une source d’ondes progressives périodiques circulaires.
2.7. 0,75 pt. Il faut que la largeur de l’ouverture soit du même ordre de grandeur que la longueur d’onde des ondes
sonores. Comme 20 Hz < fson < 20 × 103 Hz , v = 340 m.s–1 et
Son
Son Son
v
f
:
340
20 x 103 = 1,7 x 10–2 m < SON < 340
20 = 17 m ; conclusion : 1,7 cm < a < 17 m.
7cliché = 1,75 cm
1
/
4
100%