UE 1 Biochimie

PACES - UE 1 : Biochimie – Dr E. TIENNAULT-DESBORDES - IPECO – Année 2015-2016
1
UE 1
Biochimie
57-59 rue Victor Schoelcher
86000 POITIERS
Tel : 0549607669

PACES - UE 1 : Biochimie – Dr E. TIENNAULT-DESBORDES - IPECO – Année 2015-2016
2
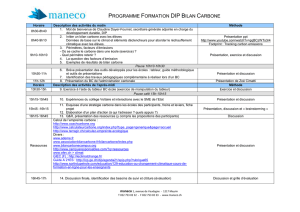
Les glucides (saccharides) sont des biomolécules très importantes. Ils sont encore
appelés les sucres, ou hydrates de carbone, ou encore carbohydrates car un très grand
nombre répond à la formule : C
n
(H
2
O)
n
.
Les sucres représentent une source d’énergie pour les organismes vivants, soit
immédiatement utilisable (glucose), soit sous forme de réserve (amidon, glycogène). Ils
peuvent également avoir un rôle structural (cellulose des végétaux) ou être des composants
de métabolites (les coenzymes (petites molécules nécessaires à l’activité de certaines
enzymes) mais aussi les monomères composant les acides nucléiques).
I. Structure des glucides
11. 3 catégories de glucides :
111. les oses ou monosaccharides (sucres simples) :
Ils sont non hydrolysables. Une seule unité comportant de 3 à 8 atomes de carbone ; selon
leur nombre de carbone, on les appelle des trioses, tétroses, pentoses, hexoses…
De plus, s’ils sont porteurs d’une fonction aldéhyde (-CHO) ou cétone (-CO-), on les appelle
respectivement, des aldoses ou des cétoses, de sorte que si l’on veut indiquer tout à la fois
la nature de la fonction carbonylée et le nombre d’atomes de C, on dira : aldopentoses,
cétohexoses…
Nomenclature : le carbone le plus oxydé porte l’indice le plus faible.
Ex : Le glucose en représentation de Fisher
Les carbones se situent à l’intersection des traits verticaux et horizontaux.
ou en écriture simplifiée (les H sont sous-entendus):
Le numéro des carbones est indiqué en rouge.
112. les osides
Ils résultent de la condensation, avec élimination d’eau, de molécules d’oses et
éventuellement de substances non glucidiques. Ils sont hydrolysables.
-les holosides : sont formés par la réunion de motifs exclusivement glucidiques. On
peut distinguer 2 catégories
• les oligoholosides (ou oligosaccharides) avec un nombre de
résidus glucidiques inférieur à 10
• les polyholosides (ou polysaccharides, ou osanes) avec un
nombre > à 10 voire avec des milliers de résidus.
Si ces polyholosides sont homogènes, on les nomme homopolyosides ou homoglycanes
(amidon, cellulose, glycogène)
- les hétérosides : proviennent de la condensation d’oses et de substances non
glucidiques appelées aglycone. Si dans l’hétéroside, l’aglycone est lié au résidu glucidique :
• par un groupe oxygène : c’est un O-hétéroside
LES GLUCIDES
1
6

PACES - UE 1 : Biochimie – Dr E. TIENNAULT-DESBORDES - IPECO – Année 2015-2016
3
• par un atome d’azote : c’est un N-hétéroside
Exemple : les nucléotides (AMP, GTP, …)
AMP : Adénosine monophosphate
= (adénine + ribose + adénine)
113. les glycoconjuguées :
Ce sont des oses liés à d'autres biomolécules
• liés à des protéines ou peptides de manière covalente :
protéoglycanes, peptidoglycanes et glycoprotéines
• liés à des lipides : glycolipides
12. Isomérie
121. La chiralité des molécules
Une molécule possède des propriétés optiques si elle est chirale (capacité de faire dévier le
plan de la lumière polarisée).
Une molécule est chirale : -si elle diffère de sa symétrique par rapport à un plan (image
dans un miroir non superposable).
-si elle possède au moins un carbone asymétrique.
-si elle ne possède pas de plan de symétrie.
Un carbone asymétrique (symbolisé par *) possède 4 groupements ou substituants
différents.
Des énantiomères (ou antipodes optiques) sont des isomères de configuration, symétriques
par rapport à un miroir et non superposables.
Des diastéréoisomères sont des isomères de configuration non-images l’un de l’autre dans
un miroir.
Des stéréoisomères sont des isomères de configuration regroupant les énantiomères et les
diastéréoisomères possibles d’une molécule. Ils se différencient les uns des autres par la
position des 4 substituants dans l’espace.
122. Configuration des oses simples
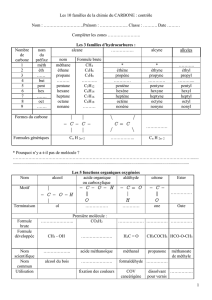
*Dans la série des sucres, on trouve au moins un carbone asymétrique :
- l’aldotriose, le glycéraldéhyde : CH
2
OH-C*HOH-CHOH en possède un ;
- le cétotriose (la dihydroxyacétone : CH
2
OH-CO-CH
2
OH) étant le seul à ne pas posséder de
carbone asymétrique).
Les oses se représentant en Fisher comme ci-après. On définit une configuration D ou L à
partir de la position de l’hydroxyle voisin de la fonction alcool primaire :
- si cet OH est situé à droite du plan formé par la chaîne carbonée :
configuration D.
- si cet OH est situé à gauche : configuration L.
N
O
O
OHOH
P
O
OH
OH N
N
N
NH
2
Adénine
Groupement phosphate
Ribose

PACES - UE 1 : Biochimie – Dr E. TIENNAULT-DESBORDES - IPECO – Année 2015-2016
4
On remarquera que les oses naturels sont pour la plupart de la série D.
On rappelle ici que l ‘appartenance à la série D ou L n’implique pas un signe déterminé pour
le pouvoir rotatoire (= capacité à dévier la lumière polarisée).
*Le nombre de stéréoisomères pour un ose regroupe les isomères de la série D et leur
image dans un miroir, la série L appelés des énantiomères. Lorsque 2 isomères ne
diffèrent que par la configuration d’un seul OH, ce ne sont plus des énantiomères mais des
diastéréoisomères.
Par contre, lorsque dans une même série (D ou L) 2 isomères ne différent que par la
configuration d’un seul OH, ce sont des épimères. L’épimérisation peut-être réalisée
chimiquement ou par réaction enzymatique (exemple : le glucose est l’épimère en C2 du
mannose et l’épimère en C4 du galactose).
Les numéros en rouge indiquent les numéros de l’atome de carbone.
*Quand la lumière polarisée traverse une substance optiquement active, le faisceau
lumineux va être dévié : -vers la droite, le composé est dextrogyre (+)
-vers la gauche, le composé est lévogyre (-).
123. Structure cyclique (cycles pyrane et furane)
Si l’on a écrit les oses sous forme linéaire jusqu’à présent, les oses en solution existe
sous forme cyclique (99% contre 1% sous forme linéaire). L’apparition d’un cycle est due à
l’élimination d’une molécule d’eau entre la fonction aldéhyde ou cétone et un hydroxyle.
Dans les 2 cas, la fonction réductrice est sous forme semi-acétal ou hémiacétal. La formation
du cycle fait apparaître un carbone asymétrique supplémentaire (C1 pour les aldoses, C2
pour les cétoses). Cette asymétrie supplémentaire définit une isomérie supplémentaire, les
Fonction aldéhyde
Série L
Fonction alcool primaire
Série D
D-glucose L-glucose
D-glucose D-mannose
1
6
2
Miroir

PACES - UE 1 : Biochimie – Dr E. TIENNAULT-DESBORDES - IPECO – Année 2015-2016
5
2
isomères α ou β suivant la position de l’hydroxyle porté par ce carbone, appelés des
anomères : - Pour un ose de la série D, si OH est situé au dessous du plan d’un
cycle pyrane ou furane: c’est un anomère α
- Pour un ose de la série L, si OH est situé au dessous du plan d’un
cycle pyrane ou furane: c’est un anomère β
- Formation d’un hémiacétal (aldéhyde ou cétone+ alcool ) :
R-CHO + R’-CH
2
OH R-CHOH-O-CH
2
-R’ + H
2
0
- Formation d’un hémiacétal sur un cycle pyrane (6 sommets): exemple du D-glucose
A partir de la forme linéaire, faire pivoter la molécule sur le côté droit :
Les numéros en rouge indiquent les numéros de l’atome de carbone.
Les hydroxyles côté droit se retrouvent en dessous du cycle et les hydroxyles côté gauche
vers le haut. Attention : par convention le carbone 6 porteur de la fonction alcool primaire se
retrouve au dessus du cycle lorsque le sucre est de la série D et en dessous du cycle pour la
série L.
La libre rotation entre le carbone 2 et la fonction aldéhyde permet d’aboutir aux deux
anomères du D-glucopyranose (1 : β-D-glucopyranose et 2 : α-D-glucopyranose).
- Formation d’un hémiacétal sur un cycle furane : exemple du D-fructose
Par le même mécanisme, on obtient l’alpha et le bêta-fructofuranose par cyclisation entre
l’hydroxyle du carbone 5 et la fonction cétone portée par le carbone 2.
Il y a également formation des deux anomères (1 : β-D-fructofuranose ; 2 : α-D-
fructofuranose)
Rem : La forme furanose peut être adoptée par les aldohexoses tel que le glucose par
cyclisation entre le carbone 4 et le carbone 1 pour donner le glucofuranose.
1
2
1
5 5
1
1
5 5
5
2
2
2
1
1
1
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
1
/
19
100%