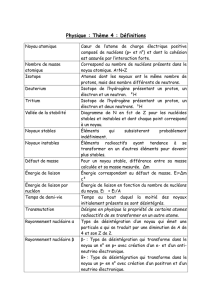
Chap 7B - Essentiel Physique nucléaire

Première S www.sciencesphysiques.info
Chapitre n°6 : transformations nucléaires Page 1 / 7
Transformations nucléaires
Une transformation nucléaire modifie la structure du noyau d’un atome,
contrairement à une réaction chimique qui ne fait intervenir que son nuage électronique.
I - Rappels sur la composition des atomes
Un atome est constitué d’un noyau chargé positivement entouré d’un nuage électronique chargé
négativement de manière à ce que l’atome soit toujours neutre.
1. Les particules élémentaires
Proton Neutron Electron
Masse 1,67.10
-27
kg 1,67.10
-27
kg 9,11.10
-31
kg
Charge électrique + 1,6.10
-19
C 0 – 1,6.10
-19
C
Les électrons gravitent dans le nuage électronique. Les protons et les neutrons sont les particules
constitutives du noyau atomique, on les appelle nucléons.
2. Le noyau atomique
Dimensions
Le rayon nucléaire est environ 100000 fois plus petit que le rayon atomique : le rayon atomique est de l’ordre
de 10
-10
m alors que le rayon nucléaire est de l’ordre de 10
-15
m.
Notation
Un noyau atomique est constitué de nucléons, c’est-à-dire de protons et de neutrons.
Le noyau d’un atome est noté
X
A
Z
A est le nombre de masse, équivalent au nombre de protons et de neutrons.
Z est le numéro atomique, équivalent au nombre de protons.
Charge électrique
Un proton porte une charge élémentaire positive +e. La charge électrique « q » d’un noyau est :
q = Z × e La charge élémentaire « e » vaut 1,6.10
-19
C (Coulombs)
Les protons étant tous positifs, il y a dans un noyau atomique de fortes répulsions électriques entre les
protons. La cohésion d’un noyau est assurée par un autre type de force, plus importante que les répulsions
électriques lorsque les particules sont très proches, appelée « interaction forte ».
Unité de masse atomique
Les grammes ou kilogrammes étant des unités peu adaptées aux très faibles masses des noyaux atomiques,
on exprime souvent en unité de masse atomique, notée « u » :
Par définition : 1 u = 1,66.10
-27
kg
Une unité de masse atomique est le douzième de la masse exacte d’un atome de carbone
C
12
6
.

Première S www.sciencesphysiques.info
Chapitre n°6 : transformations nucléaires Page 2 / 7
3. Elément chimique
Un élément chimique est défini par son numéro atomique Z. Un même élément peut être représenté par son
atome ou son ion monoatomique.
Exemples Z = 1 Elément hydrogène (atome H ou ion H
+
)
Z = 8 Elément oxygène (atome O ou ion O
2-
)
Z = 29 Elément cuivre (atome Cu ou ion Cu
2+
)
Remarque On appelle nucléides l’ensemble des atomes de noyaux parfaitement identiques
(même numéro atomique Z et même nombre de masse A).
4. Isotopes d’un élément
Des isotopes ont même numéro atomique Z mais des nombres de masse A différents. Ils ont donc le même
nombre de protons mais des nombres de neutrons différents.
Exemple l’élément carbone C admet trois isotopes
C
12
6
C
13
6
C
14
6
Dans le tableau de la classification périodique, chaque élément chimique est représenté par son isotope le
plus abondant. On ne trouvera par exemple pour l’élément carbone que l’isotope C
12
6
, qui est le plus
abondant dans la nature.
Le nombre de neutrons n’étant pas le même dans tous les isotopes d’un même élément, la masse atomique
change d’un isotope à l’autre. La masse molaire d’un élément est donc la moyenne pondérée des masses de
tous ses isotopes.
Exemple
L’élément chlore admet deux isotopes : 75% de l’isotope Cl
35
17
et 25 % de l’isotope Cl
37
17
La masse molaire de l’élément chlore est donc M
Cl
= 35,5 g.mol
-1
II - Radioactivité d’un noyau : la désintégration spontanée
1.
Cohésion d’un noyau
Les protons étant chargés positivement, tout noyau atomique est le siège de répulsions électriques entre les
protons qu’il contient. Il ne devrait donc pas pouvoir exister (voir les calculs faits en TP).
On explique sa cohésion par l’existence d’une force appelée interaction forte, toujours attractive et exercée
entre tous les nucléons (protons + neutrons).
si le nombre de protons est limité par rapport aux neutrons, cette interaction forte prédomine sur les
répulsions électriques et le noyau est stable.
si en revanche, le nombre de protons est trop important, les répulsions électriques deviennent trop
importantes et le noyau risque d’éclater : le noyau est alors instable.
Un noyau atomique instable est appelé « radioactif ». La majorité des gros atomes sont radioactifs, ainsi que
certains isotopes de petits noyaux. Le phénomène de radioactivité a été découvert à la fin du XIX° siècle par
Henri Becquerel.
La décomposition d’un noyau est toujours accompagnée d’un rayonnement nommé
α
,
β
, ou
γ
.

Première S www.sciencesphysiques.info
Chapitre n°6 : transformations nucléaires Page 3 / 7
2. Diagramme de Segré (diagramme N/Z)
La centaine d’éléments existants permet environ 350 isotopes naturels différents, dont une soixantaine sont
instables, et l’on a fabriqué plus de 1500 noyaux artificiels tous instables. On représente sur un diagramme N
en fonction de Z l’ensemble des noyaux atomiques connus. Les différentes couleurs indiquent la stabilité ou
non-stabilité de chacun des noyaux, et le type de rayonnement émis en cas de décomposition (voir page 139).
Dans la zone rouge apparaissent les noyaux stables. Cette
zone est appelée vallée de stabilité. On remarque que pour
Z < 30 les noyaux stables sont situés sur la première
bissectrice (ou dans son voisinage immédiat), ce sont donc
des noyaux pour lesquels N = Z.
Dans la zone verte se situent des noyaux donnant lieu à une
radioactivité de type α. Ce sont des noyaux lourds (N et Z
sont grands donc A est grand).
Dans la zone bleue se situent des noyaux donnant lieu à une
radioactivité de type β
-
. Ce sont des noyaux qui présentent
un excès de neutrons par rapport aux noyaux stables de
même nombre de masse A.
Dans la zone jaune se situent des noyaux donnant lieu à une
radioactivité β
+
. Ce sont des noyaux qui présentent un
excès de protons par rapport aux noyaux stables de même
nombre de masse A.
3. Propriétés de la désintégration
La désintégration radioactive est :
Aléatoire : il est impossible de prévoir quand va se produire la désintégration du noyau.
Spontanée : la désintégration se produit sans aucune intervention extérieure.
Inéluctable : un noyau radioactif se désintégrera tôt ou tard.
Indépendante de la combinaison chimique dont le noyau radioactif fait partie.
Indépendante des paramètres extérieurs tels que la pression ou la température.
4. Lois de conservation
Lorsqu’un noyau éclate spontanément, il est qualifié de « noyau père ». Sa désintégration conduit alors à un
nouveau noyau appelé « noyau fils » et à l’émission de particules diverses. Un nouvel élément chimique est
alors crée, ce qui est impossible en Chimie. Contrairement à la réaction chimique, le noyau atomique n’est
donc pas conservé dans une réaction nucléaire. Toutefois, la désintégration radioactive admet des lois de
conservation (lois de Soddy) :
la somme des nombres de masse des particules en réaction est conservée.
la somme des charges électriques des particules est conservée.
l’énergie totale est conservée, mais peut changer de forme : l’énergie de masse peut être transférée sous
forme d’énergie cinétique par exemple. C’est ce que traduit la relation d’Einstein E = mC
2
qui sera
étudiée dans la suite du cours.

Première S www.sciencesphysiques.info
Chapitre n°6 : transformations nucléaires Page 4 / 7
5. Différentes formes de désintégrations
On distinguera trois formes de radioactivité, selon la nature des particules émises lors de la désintégration : la
radioactivité α, la radioactivité β
-
et la radioactivité β
+
.
Radioactivité α
La radioactivité α est l’émission de noyaux d’hélium
He
4
2
, appelés aussi particules
α
, lors de la
désintégration d’un noyau père. Les noyaux qui donnent lieu à ce type de radioactivité ont des numéros
atomiques élevés (Z > 82).
Pour un noyau père X donnant par désintégration
α
un noyau fils Y, on écrira :
He Y X
4
2
4A 2Z
A
Z
+→
−
−
Exemple
La désintégration de l’isotope 226 du radium conduit à un isotope du radon, lui-même radioactif. L’équation
de cette réaction nucléaire est donc :
He Rn Ra
4
2
222
86
226
88
+→
Une particule He a été éjectée donc il s’agit de radioactivité
α
.
Sécurité
Les particules
α
émises ont une vitesse de l’ordre de 20000 km.s
-1
. Elles provoquent l’ionisation de la
matière qu’elles rencontrent, mais sont peu pénétrantes : une simple feuille de papier suffit à les arrêter.
Radioactivité
β
-
La radioactivité
β
-
est l’émission d’électrons par certains noyaux. On notera l’électron e
0
1−
puisqu’il n’est pas
un nucléon et porte une charge négative. Cette désintégration est toujours accompagnée de l’émission d’un
antineutrino, particule difficilement détectable, dont la masse et la charge électrique sont nulles.
L’antineutrino sera noté
υ
.
Pour un noyau père X donnant par désintégration
β
-
un noyau fils Y, on écrira :
υ++→
−+ 0
0
0
1
A
1Z
A
Z
e Y X
Exemple
La désintégration du carbone 14 conduit à l’isotope 14 de l’azote.
L’équation de cette désintégration est :
υ++→
−0
0
0
1
14
7
14
6
e N C
Sécurité
L’énergie libérée par ce type de désintégration est emportée par l’électron, éjecté à une vitesse de l’ordre de
280000 km.s
-1
et par l’antineutrino de vitesse presque égale à celle de la lumière dans le vide. Les électrons
ainsi produits peuvent traverser une plaque métallique de plusieurs millimètres. Les neutrinos n’interagissent
pratiquement pas avec la matière et peuvent traverser la Terre sans être arrêtés.

Première S www.sciencesphysiques.info
Chapitre n°6 : transformations nucléaires Page 5 / 7
Radioactivité β
+
La radioactivité β
+
est l’émission de positrons (ou positons) par certains noyaux. Le positron est
l’antiparticule de l’électron, c’est-à-dire qu’il possède même nombre de masse mais une charge opposée. On
le notera
e
0
1
. Cette désintégration est toujours accompagnée de l’émission d’un neutrino, antiparticule de
l’antineutrino. Le neutrino sera noté
υ
.
Pour un noyau père X donnant par désintégration
β
+
un noyau fils Y, on écrira :
υ++→
−0
0
0
1
A
1Z
A
Z
e Y X
Exemple
La désintégration de l’isotope P
30
15
du phosphore (obtenu en bombardant une
feuille d’aluminium avec des particules
α
) conduit à l’isotope Si
30
14
du
silicium. L’équation de cette désintégration est :
υ++→
0
0
0
1
30
14
30
15
e Si P
Sécurité
Les vitesses et énergies des rayonnements émis sont du même ordre que pour la radioactivité
β
-
. La
radioactivité
β
+
est qualifiée de radioactivité artificielle car elle ne se produit que sur des nucléides fabriqués
artificiellement.
6.
Le rayonnement
γ
Lors des désintégrations précédentes, les noyaux fils produits
sont dans un état excité. Leur désexcitation provoque l’émission
d’un rayonnement électromagnétique très énergétique que l’on
appelle rayonnement gamma
γ
.
γ+→
∗
Rn Rn
La fréquence de ces rayonnement est de l’ordre de 10
20
Hz, et
leur capacité de pénétration est très importante : un
rayonnement gamma peut traverser plusieurs mètres de béton.
III - Masse et énergie
1.
Exemple : la masse nucléaire de l’hélium
Connaissant les masses respectives du proton (m
P
= 1,00728u) et du neutron (m
N
= 1,00866u), calculons la
masse nucléaire de l’hélium :
m
He
= 2 × m
P
+ 2 × m
N
= 2 × 1,00728 + 2 × 1,00866 = 4,03188 u
or les tables donnent, pour le noyau d’hélium : m
He
= 4,00150 u
Le noyau d’hélium est donc plus léger que la somme des masses des nucléons qui le constituent. Il n’y a pas
conservation de la masse lors de sa constitution à partir des particules élémentaires. La différence de masse
correspond à une énergie à fournir si l’on veut séparer le noyau d’hélium en particules indépendantes.
 6
6
 7
7
1
/
7
100%