LA PHYSIQUE QUANTIQUE

http://m olaire 1.perso.sfr.fr/plan.html
1
LA PHYSIQUE QUANTIQUE
I. HISTOIRE DE L'ATOME
II. L'ATOME CLASSIQUE
A. Le proton et le tableau périodique
B. Le neutron
C. Les électrons et les molécules
D. La radioactivité
III. LA PHYSIQUE QUANTIQUE
A. Les photons et la dualité onde-corpuscule
B. Orbitales et Principe d'Heisenberg
C. Principe de Pauli, Fermions et Bosons
D. Le paradoxe du chat de Schrödinger
E. La non-séparabilité quantique
F. Le principe de non-localité
IV. LA MATIERE AUJOURD'HUI
A. Les quarks et les neutrinos
B. L'antimatière et les autres familles de particules
V. LES 4 INTERACTIONS:
A. Généralités
B. La gravitation
C. L'interaction électromagnétique
D. L'interaction forte
E. L'interaction faible
VI. LES THEORIES ACTUELLES:
A. Le modèle standard
B. L'interaction électrofaible et électronucléaire
C. Superforce, supersymétrie et supercordes
D. Big Bang.

http://m olaire 1.perso.sfr.fr/plan.html
2
I. HISTOIRE DE L'ATOME
Le mot "atome" vient du grec "a-tomos" et signifie "insécable". Cette notion fut inventée par L. de
Milet en 420 avant J.C.
En 1897, Thompson découvre le premier composant de l'atome: l'électron, particule de charge
électrique négative.
En 1912, Rutherford découvre le noyau atomique.
Les électrons de l'atome se déplacent autour de ce noyau tels des planètes autour du Soleil, et la
force électrique attractive (la charge - de l'électron attirant la charge + du noyau) joue le rôle de
la force de gravitation pour les planètes; d'où le nom de modèle d'atome planétaire.
Rutherford comprend que le noyau est lui-même composé de nucléons. Ces nucléons sont de
deux sortes:
de charge positive, c'est un proton.
de charge neutre, c'est un neutron
Le modèle planétaire de l'atome présente un gros défaut. Les électrons peuvent émettre de la
lumière sous certaines conditions (dans une ampoule électrique par exemple); ce faisant, ils
perdent de l'énergie et devraient donc se rapprocher du noyau jusqu'à s'y écraser!
Un tel atome ne serait donc pas stable.
Pour rendre compte de la stabilité atomique, N. Bohr crée en 1913 un nouveau modèle d'atome:
Les orbites des électrons ne sont pas quelconques mais quantifiées; seules certaines orbites
particulières sont permises pour l'électron. Ce n'est que lorsque celui -ci saute d'une orbite à
l'autre qu'il peut émettre (ou absorber) de la lumière.
Et bien ce modèle est faux car, à l'échelle atomique, de nouvelles lois s'appliquent! Ces lois
appartiennent à la physique quantique.

http://m olaire 1.perso.sfr.fr/plan.html
3
II. L'ATOME CLASSIQUE
A. Le proton et le neutron
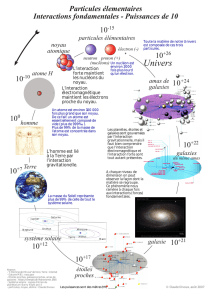
Dans la nature, il existe environ 90 atomes différents.
L'atome le plus abondant de l'Univers est l'hydrogène (75% de la matière totale du cosmos)
L'hydrogène possède un noyau formé de 1 proton autour duquel tourne 1 électron.
L'hydrogène a des isotopes (cad même nombre de protons, mais nombre différent de neutrons).
A noter que certains isotopes sont radioactifs et donc instables.
Neutron et proton forment la famille des nucléons.
Un atome comme le carbone est noté symboliquement
avec A=12 (nb de nucléons)
et Z=6 (nb de charge)
B. Les électrons et les molécules
L'électron est noté en physique e-
Les électrons sont organisés en couches successives autour du noyau selon des règles de
remplissage très strictes (loi d'exclusion de Pauli).
Ce sont les électrons les plus externes qui sont responsables de
toute la chimie, car ce sont eux qui peuvent relier mutuellement
deux atomes distincts en créant des liaisons chimiques.
Par exemple, deux atomes peuvent chacun mettre en commun un
de leurs électrons et ainsi créer ce qu'on appelle une liaison
chimique covalente.
L'association de deux atomes (ou plus) forme une molécule.
Le volume de l'électron est mille fois plus petit que celui du proton. Le volume du noyau étant un
million de milliards de fois plus petit que celui de l'atome, le volume de l'atome est donc
constitué d'au moins 99,9999999999999 % de vide!

http://m olaire 1.perso.sfr.fr/plan.html
4
C. La radioactivité
Il existe trois variétés de radioactivité caractérisées par l'émission de différents rayons par le
noyau de l'atome:
les rayons alpha) composées de deux protons et de deux neutrons (en fait un noyau
d'Hélium).
les rayons (bêta) il existe deux sortes de rayon :
o les qui sont des électrons.
o les qui sont des antiélectrons.
les rayons (gamma) sont constitués de photons de haute énergie. Ils sont dûs au
réarrangement interne des nucléons du noyau. Dès qu'un nucléon glisse d'une couche
nucléaire externe vers une couche plus interne (et donc moins énergétique), ce dernier
cède de l'énergie sous forme de photon .
Chaque réaction nucléaire d'un atome n'émet qu'un seul type de rayonnement à la fois.
Cette transformation de noyaux atomiques s'appelle une réaction nucléaire dont deux exemples
font beaucoup parler d'eux: la fission et la fusion nucléaire.
1. La fission nucléaire
Lorsque le noyau d'un atome lourd fissionne en deux noyaux plus petits, l'addition des masses
des deux noyaux résiduels est inférieure à la masse du gros noyau d'origine . La masse
manquante s'est transformée en une énorme quantité d'énergie pure, (équivalence masse-énergie
d'Einstein)
2. La fusion nucléaire
Deux noyaux légers d'atomes se percutent et fusionnent en un noyau plus gros. Or la masse
finale de ce gros noyau est plus petite que la somme des masses des deux noyaux initiaux, d'où
un énorme dégagement d'énergie.
Pour pouvoir provoquer une telle réaction de fusion, il faut forcer les noyaux, tous chargés
positivement, à se rapprocher et à vaincre leur répulsion mutuelle : ceci n'est possible qu'à de
très hautes températures. C'est pourquoi la réaction de fusion nucléaire est aussi appelée
réaction thermonucléaire.

http://m olaire 1.perso.sfr.fr/plan.html
5
III. LA PHYSIQUE QUANTIQUE
La physique quantique signifie littéralement "physique des quanta" (pluriel latin de "quantum"
qui signifie quantité).
A. Les photons et la dualité onde-corpuscule
A la fin du XIXe siècle, J. Maxwell définit la lumière comme étant un faisceau continu d'ondes
électromagnétiques se déplaçant à vitesse constante dans le vide. La lumière est caractérisée par
sa fréquence ou sa longueur d'onde.
En 1900 M. Planck postule l'idée selon laquelle les échanges d'énergie entre la lumière et la
matière ne peuvent se faire que par paquets discontinus, que l'on appellera les quanta.
Ce "grain d'énergie" sera appelé photon par A. Einstein. Chaque photon d'un rayonnement
(lumière, ondes radios, rayons X...) est porteur d'un quantum d'énergie caractéristique de sa
fréquence.
La physique quantique va donc associer une onde et une particule. C'est la dualité onde-
corpuscule.
L'ancienne physique, dite classique, distingue deux sortes d'entités fondamentales:
Les corpuscules, qui sont des sortes de billes microscopiques,
Les ondes, qui se propagent dans l'espace (un peu comme une onde sur l'eau)
La physique quantique considère que les objets ne sont ni des corpuscules, ni des ondes, mais
"autre chose".
N. Bohr explique que l'émission de photon provient du saut d'un électron d'une orbite E2 à une
orbite E1 moins énergétique. (E1-E2 = hv avec v : fréquence du photon émis).
Sa théorie quantique stipule que seules sont permises les orbites permettant d'émettre ou
d'absorber un photon d'une énergie multiple de la Cste de Planck h.
B. Orbitales et Principe d'Heisenberg
La physique quantique va rendre le modèle de Bohr caduque .
Les orbites électroniques font place à la notion d'orbitales, sorte de sphères floues et
probabilistes, dans lesquelles l'électron serait en quelque sorte dilué tout autour du noyau.
La forme des orbitales:
L'orbitale de l'hydrogène est la plus simple : elle est sphérique car son
électron est tout seul.
Les autres atomes, ont des orbitales beaucoup plus complexes car
leur couche électronique externe contient plusieurs électrons dilués
en autant d'orbitales distinctes.
La physique quantique excluant que deux orbitales électroniques
puissent se superposer, ces orbitales externes se repoussent donc
mutuellement et prennent des aspects plus complexes:
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
1
/
15
100%