1 Le système immunitaire - Bienvenue sur PLS Amiens

1
Philippe Pulwermacher-Blanchard
Le système immunitaire
- Ensemble des mécanismes cellulaire et moléculaires capable de répondre de manière collective et coordonnée à l’introduction d’une substance
étrangère (infectieuse ou non), dans l’organisme.
- Principaux acteurs :
Ȼ hématopoïétiques (LT, LB, monocytes/macrophages, LNK, cellules dendritiques) : toutes ces cellules expriment des récepteurs,
produisent diverses enzymes et sécrètent diverses substances solubles (cytokines, compléments, peptides antibactériens)
Ȼ endothéliales : passage + régulation de l’entrée des cellules immunitaires dans les tissus et la sortie de ces cellules par leurs organes
producteurs.
Ȼ épithéliales (thymus, muqueuses…)
I) Les antigènes
Généralités
- Substance immunogène = capable de lier un Ac ou un récepteur T sans avoir d’effet sur la cellule cible.
- Antigène (Ag) = substance capable de lier Ac ou récepteur T et de déclencher une réponse immunitaire
substance immunogène déclenchant un effet
Pas de lien connu entre structure physico-chimique et capacité de réponse
≠ nature (protéines, lipides, glucides, acides nucléiques) : souvent mixte (glycolipides, glycoprotéines, ribonucléoprotéines,
molécules de synthèse…)
Interaction Ac/Ag = liaisons hydrogène, hydrophobe, électrostatique et Van der Walls
- Epitope (déterminant antigénique) = partie de l’Ag pouvant être reconnue par un Ac ou un
récepteur T
Hiérarchie entre épitopes lorsque que l’Ag est introduit dans l’organisme (primordial
pour vaccination)
- Auto-antigène (exprimé par le système immunitaire), allo-antigène (existe dans la même
espèce mais dans un corps ≠), xéno-antigène (appartient à une espèce différente)
- CPA : LB, Ȼ dendritiques, monocytes/macrophages
Antigènes
reconnus par les
anticorps
Protéines
Polysaccharides
Lipides
Acides nucléiques
Haptène
- Structure linéaire ou 3D
- Formes soluble ou solide (surface Ȼ ou bactérie)
- Epitope continu (séquentiel) : linéaire avec une séquence
primaire ; même dénaturé tjr reconnu par Ac.
- Epitope discontinu (conformationnel) : formés d’AA ≠
rapprochés grâce à un pont disulfure (boucles + ou – éloignées)
sans ces ponts, Ac ne reconnaissent pas l’Ag.
- Sucres simples (5-6 oses) ou
polymères de sucres linéaires ou
branchés
- Svt 1 unité répété tout au long de la
chaîne :
Polyfructose : LEVANE
Polygalactose : GALACTANE
Polyglucose : DEXTRANE
- Rarement reconnus comme Ag.
- Glycolipides = fréquents
- ADN ou ARN
- Ce sont soit des hormones, des métaux lourds (chrome, nickel…), des
médicaments (péniciline) et différents produits chimiques de synthèse.
- Pour déclencher la réponse immunitaire, il doit se lier à une protéine
(complexe haptène-protéine)
- LB va générer 3 types d’Ac : contre l’haptène isolée, contre la liaison
protéines-haptène, contre la protéine porteuse
Récepteur des
LT : le TCR
- Ne reconnait pas de structure 3D
- Reconnait un peptide mais jamais à l’état soluble association à une molécule du complexe majeur
d’histocompatibilité (molécule HLA) liaison au CMH = « restriction au CMH »
- Exceptions : lymphocytes T-NK (immunité T innée ; abondants dans le foie) = reconnaissent des glycolipides associés
à des molécules non classiques du système d’histocompatibilité (ex : molécule CD1)
- Ȼ MAIT (rate + TD) reconnaissent protéines ou substances bactériennes associés à une molécule voisine du système
majeur d’histocompatibilité (MR1)
- ≠ LT CD4 et LT CD8 = reconnaissance d’un complexe d’histocompatibilité différent
LT CD4 : reconnait peptides associés au CMH II.
LT CD8 : peptides associés au CMHI
Super-antigène
- S’interpose entre le récepteur T et la molécule CMHII
- Liaison par une extrémité à CMHII et par une autre à la chaine β du récepteur T rapproche les 2 Ȼ et active le LT (non-spécifique) = forte production de LT (T4/T8)
- Ǝ beaucoup de maladies engendrées par un SA
II) L’immunité innée

2
Philippe Pulwermacher-Blanchard
Généralités
- Ǝ chez tous les êtres vivants du règne animal et végétal
- 1ère ligne de défense de l’organisme
- Immunité naturelle, native
- Mécanisme effecteur de déclenchement rapide (quelques heures)
- Reconnait de façon grossière des micro-organismes
Distinction « soi »/ « non soi »
Activation simultanées de nombreuses Ȼ
- Interagit avec l’immunité adaptative (l’induit) = systèmes complémentaires
Effecteurs
Barrières naturelles
- Phagocytes (PNN, monocytes/macrophages, Ȼ dendritique), NK, (T-NK, MAIT = minoritaires)
Expriment des récepteurs membranaires ou solubles et des récepteurs intracellulaires (PPR) reconnaissance du « soi » et du « non soi »
Pas de récepteurs spécifiques à l’Ag
- Barrière Ȼaire naturelle (épithélium, endothélium)
Sécrétions d’enzymes, de molécules d’adhésion, de cytokines
Effecteurs solubles (système du complément, kinine, prostaglandine, leucotriènes, chimiokine, peptides antimicrobiens…)
- Peau, intestin, poumons, yeux/nez = Ȼ épithéliales attachées par des jonctions serrés
- Besoin de système de défense au niveau des voies d’entrée
- Si effraction de ces barrières, les pathogènes vont rencontrer en premier lieu les macrophages résidents
(présents dans tous les tissus)
Effecteurs Ȼaire
résidants dans
les tissus
Les macrophages
TLR (Toll Like Receptor)
Protéines NOD
Etapes de la phagocytose
- Forme mature des monocytes
- ≠ noms selon les tissus (ex : Ȼ microgliales, Ȼ de Kupfer)
- Très nombreux dans TC (poumons, rate, foie, tractus
gastro-intestinal)
- Caractéristiques communes aux Ȼ phagocytaires : +++
Reconnaissance grossière des micro-organismes : PAMP
(Pathogen-Associated Moleculad Patternes)
permet
distinction « soi »/ « non soi » grâce aux récepteurs PPR,
situés sur toutes les Ȼ phagocytaires.
- Présents en surface ou sur une vésicule intracellulaire (10 ont été identifiés chez l’Homme)
- Exprimés par Ȼ immunitaires (phagocytes +++) et Ȼ non-immunitaires (Ȼ endothéliales)
- Reconnaissent éléments présents sur la mb de la plupart des microorganismes pathogènes
TLR2 (bactéries, champignons), TLR3 (virus), TLR4 (bactéries)…
Liaison sur TLR3 = activation facteur de transcription IFR3 (synthèse interféron de type 1)
Liaison sur TLR4 = cascade signalisation des TLR = activation de NF-kB = synthèse de
cytokines pro-inflammatoires
Activation TLR = réponse adaptée au pathogène
- Uniquement au niveau du cytosol +++
(phagocytes + Ȼ épithéliales)
- Permettent expression des molécules de co-
stimulation (monocytes/macrophages) activation
des lymphocytes lors de la présentation de l’Ag
- Liaison du pathogène par le phagocyte
(« récepteurs motifs »)
- Ingestion du pathogène par le phagocyte
- Formation du phagosome
- Fusion phagosome/lysosome = phagolysosome
- Digestion du pathogène par enzymes du
phagolysosome
- Elimination
Phase soluble de
la réponse innée
Système du complément
Cytokines
- « Complète » effet antibactérien des Ac
- 35 protéines solubles dans liquides biologiques + tissus (production hépatique +++)
- Activation en cascade (SC activé qu’à la surface des pathogènes)
Précurseurs inactifs (zymogènes) clivés par une protéase activée = activation
Permet une amplification : qqs molécules activées au départ réaction forte
- 3 voies (peuvent être activées sur le même pathogène)
- C3 = complément le plus abondant dans le plasma, entrainant un dépôt de grande quantité
de C3b à la surface des pathogènes.
- C5 convertase = induit formation C5a (molécule soluble) + C5b
- Sécrétée par diverses Ȼ activées (immunitaires ou non)
- Uniquement sur récepteurs spécifiques à forte affinité
- Autocrine, paracrine ou endocrine
- ≠ familles :
Cytokines pro-inflammatoires par les macrophages activées
IL-1, IL-6, TNF-α = effets systémiques (foie, muscles, hypothalamus)
Chimiokines = liaison à R spécifiques sur ≠ leucocytes (action limitée), libérées par
de nombreux types Ȼaire (ex : IL8 sur neutrophiles, CCL 2 sur monocytes)
Interférons (INF-α ; INF-β) : molécules antivirales (résistance à la réplication virale
dans toutes les Ȼ, présentation Ag, activent NK pour tuer Ȼ infectées)
Voie des lectines
Voie alterne
Voie classique
- Activée par la présence de certains polysaccharides
(surface des pathogènes)
- MBL (lie mannose) change conformation de la
bactérie lors de la fixation fixation protéase MASPs
segments C2-C4 clivés C3 convertase
- Part du C3 hydrolyse spontanée C3 (H20) fixation facteur B
fixation facteur D sur l’ensemble = dégradation facteur B en Bb
- C3 convertase dégrade la molécule C3 en C3a et C3b
C3b sur Ȼ hôte = dégradé
C3b sur bactérie = reste dessus
- Ne fonctionne qu’avec les IgG et IgM
- Fixation Ig sur bactérie fixation C1q
fixation C1r + C1s complexe C1 (q, r, s) C3
convertase
- Peut être activée en l’absence d’Ac
- CRP peut activer C3 convertase
- qq soit voie d’activation, on aura l’activation du complément C3 converstase/ C5 convertase
- Conséquence biologique de l’activation du complément :
Opsonisation : reconnaissance Ȼ à phagocyter par récepteur du complément (RC) sur phagocyte
Réponse inflammatoire locale : C5a, C3a et C4a (anaphylatoxine) perméabilité vasculaire,
molécule d’adhérence, Ȼ immunitaire + phagocytose, chimiotactisme
- Voie terminale du complément : lise osmotique sur les grams – (gram + = paroi
trop épaisse)
- Si amplification rapide dès son activation = effet destructeur du complément
activation doit rester confinée à la surface des pathogènes
système de protection = ½ vie brève + protéines régulatrices (DAF, CD59)
Inflammation et
recrutement des
Ȼ circulantes
phagocytaires
Polynucléaires neutrophiles
Monocytes
- 1ère Ȼ circulantes recrutée sur le site d’infection (qqs heures)
- Capacités :
Migration : extravasation++ roulement (E-selectine à la surface de l’endothélium), adhérence
(chimiokines, intégrines LFA1, ICAM), entrée dans Ȼ endothéliales (diapédèse), dégradation dans la
membrane basale
Phagocytose et bactéricidie +++ (après phagocytose du pathogène, acidification du phagosome permettant
ralentissement croissance des bactéries voire mort)
Synthèse de cytokines
- Noyau multilobé (d’où le nom)
- Contiennent ≠ granules
- Absents des tissus sains (sang +++)
- Meurt après un cycle de phagocytose (= composant principal du pus)
éliminer par macrophage
- Migrent sur le site de l’inflammation après les PNN et se différencient en
macrophages
- Capacités : phagocytose (pathogènes + Ȼ apoptotiques), pouvoir bactéricide,
synthèses de cytokines (IL-1, IL-6, IL-8, TNF-α)
- Peuvent, après apprêtement de l’Ag, le présenter aux Ȼ de l’immunité adaptative
Cellules NK
Généralités
Activation
Coopération NK-immunité spécifique
Granules cytotoxiques
Chimiokines/ cytokines
- Grands lymphocytes granuleux capables de détecter des
altérations à la surface des Ȼ
- Reconnaissent des molécules de surface induites par le stress
métabolique (infection, transformation maligne…)
- Détection via des récepteurs invariants (activateurs, inhibiteurs =
intégration des 2 signaux) à leur surface
- Interaction avec LTCD8
- Assez de CMH1 à la surface =
prédominance du signal inhibiteur
- Pas assez = signal activateur
décharge de granules cytotoxiques
- Récepteurs pour la partie Fc (CD16) des IgG
Fixation NK sur plusieurs IgG fixée =
activation NK sécrétion perforine + granzyme
destruction Ȼ cible
- Cytotoxicité Ȼaire dépendante des Ac
- La perforine assure la libération du
granzyme dans le cytosol
- Granzyme apoptpose dégradation
ADN Ȼ + ADN/ARN viral
- Sécrétion de CCL3 (mip-1α), CCL5
(RANTES) = chimiokine recrutant Ȼ
phagocytaire
- Sécrétion de TNF-α + IFN-γ = activation Ȼ
phagocytaires (coopération NK-phagocytes)
Cellules
dendritiques
Généralités
Ȼ dendritiques immatures
Ganglions lymphatiques
- Chefs d’orchestre de la réponse immunitaire
- Présentes dans tous les tissus (périphériques + lymphoïdes)
- Ȼ phagocytaires + présentatrice d’Ag
- Rôle : transporter les agents pathogènes vers les sites d’initiation de la
réponse immunitaire spécifiques (= sentinelles du système immunitaire)
- DC conventionnelles (origine myéloïde) ≠ DC plasmocytoïdes (origine
lymphoïde, à l’état immature dans organes lymphoïdes IIaires et le sang,
réponse contre les virus +++, expriment TLR7 et 9, production interféron de
type I +++)
- Rôles : capture des Ag +++ ( localisation optimale = barrière
cutanéomuqueuse (ex : Ȼ de Langerhans dans l’épiderme), tissus
périphériques), phagocytose, macropinocytose
- 1ère étape de maturation des Ȼ dendritiques = induction du récepteur
de chimiokine CCR7 Ȼ migre ensuite vers tissus lymphoïdes +
ganglions où elle termine sa maturation CMH, molécules B7 et
molécules d’adhérence pour LT naïfs (DC = puissantes activatrices des
LT naïfs grâce à CCL18)
- Site de rencontre Ȼ dendritique/ LT naïfs induction de la réponse immunitaire adaptative (T-dépendante)
- Recirculation permanente des LT naïfs à travers les tissus lymphoïdes périphériques.
- DC arrive par vaisseaux lymphatiques ≠ LT (vaisseaux sanguins) si reconnaissance, LT prolifère,
devient Ȼ effectrice, quitte le ganglion et migre vers le site d’infection
- Activation des LT via 3 signaux :
Signal 1 : interaction peptide : CMH avec TCR
Signal 2 : costimulateur
Signal 3 : orientation de la différenciation des LT en ≠ sous-population T effectrice
Autres acteurs
cellulaires
- PN basophiles + éosinophiles (défense contre les parasites + réactions allergiques): Ȼ sécrétrices de granules contenant des enzymes et des protéines toxiques
- Mastocytes (protection des muqueuses contre les pathogènes + réactions allergiques) : Ȼ sécrétrices contenant un grand nombre de granules
Activation LT

3
Philippe Pulwermacher-Blanchard
III) L’immunité adaptative ou spécifique
Généralités
- Ȼ (LT + LB) répondent de manière spécifique à un Ag via un récepteur (BCR ou TCR)
- Peut engendrer une réponse mémoire (LT/LB) réponse + rapide et efficace
- Interconnexion entre la réponse nerveuse et immunitaire
- Sécrétion de cytokines (interleukines, interférons) = modulation réponse immunitaire
Lymphocytes B
Généralités
Lymphopoïèse B
Récepteurs B (BCR)
- Support de la réponse immunitaire humorale
spécifique
- Ȼ constituées de 2 chaines lourdes + 2 chaines légères
- Produisent l’immunoglobuline (IgG, IgA, IgM, IgE,
IgD) une fois différenciés en plasmocytes
- Avant sécrétion, Ig, à la surface des récepteurs,
reconnait via son paratope, l’épitope de l’Ag signal
d’activation de la Ȼ prolifération + différenciation
- Ȼ présentatrices de l’Ag (CPA), capables de moduler
la réponse immunitaire et de contrôler le
développement de certains lymphocytes (MAIT)
- Récepteurs spécifiques (CD19/CD20) et non-
spécifiques
- La majorité des LB circulants sont des LB matures
naïfs
LB1 : très peu spécifique et reconnaissent beaucoup
d’Ag. Peuvent exprimer CD5
LB2 conventionnels : régulateurs (inhibent et
contrôlent l’amplitude de la réponse immunitaires des
autres LB et LT), mémoires
- LB activé ne présente plus CMHII
- 5-10% des L circulants
- Durée de vie : 4-5 jours
- Seuls 10% réussiront leur différenciation (sur 100
millions par jour !)
Etape antigène indépendante
Etape antigène dépendante
- Reconnaissance de l’Ag
- Membranaire Ig soluble
- Complexe multimoléculaires
IgM avec une partie
transmembranaires et qqs AA intra-
cytoplasmique
CD79 a et CD79b de chaque côté
motif ITAM
- Recombinaison somatique
(réarrangement intra-chromosomique
au sein des loci IGH, IGK et IGL)
chaines H (lourdes) et L (légères)
associées par l’intermédiaire du BCR
- Mécanisme d’editing : si BCR ou Ig
membranaire présentent une spécificité
vis-à-vis d’un auto-antigène trop fort
réexpression du RAG éditing =
réarrangement secondaire VJ,
principalement sur les chaînes légères
pour changer le paratope
- Sécrétés contrairement aux TCR +++
- 5 classes (IgA, IgE…), 9 sous-classes
Lymphocytes pro-B
Lymphocytes pré-B
LB immature
LB mature
LB mémoires
Plasmocytes
- Pas de chaine lourde ni
légère
- Rag1 et Rag2 : coupure
au niveau des segments D,
J, V
- Molécules ku70, 180,
DNA PK, DNA ligase…
- CD10
- Igα et Igβ (cytoplasme)
- Pseudo-chaine légère
(cytoplasme)
- CD19+
- Tdt
- CD34+ expression
caractéristique des
précurseurs des Ȼ
hématopoïétiques
- Chaine lourde µ
- Pseudo-chaine légère (Vpréβ, λ5)
cytoplasme + surface
- Hétérodimère (CD79a/CD79b),
Igα, Igβ (cytoplasme + surface)
indispensable pour le transport du
complexe formé par la chaine
lourde µ + transmission du signal à
l’intérieur de la Ȼ
- ITAM (BtK, BLNK)
- CD19 +
- CD10 +
- CD 20
- = pré-B jeune (grande taille,
en prolifération)
+ = pré-B tardif (petite taille)
- Rag
- = pré-B jeune
+ = pré-B tardif
- CD34 +
- Pas de pseudo chaine
légère
- Chaine légère
conventionnelle
- Immunoglobuline M
(chaine légère et lourde
associées à Igα/ Igβ)
- CD19 +
- CD20 +
- CD40+
- CD34+
- CD19+
- CD20+
- CD40+
- Igα, Igβ (cytoplasme +
surface)
- CD34+
- CD27
- CD38
- CD138
- N’expriment plus d’Ig
en surface (tjr dans le
cytoplasme +++) ni de
CD79a, CD79b, CD19 et
CD20
- Stimulation du récepteur :
Transmission du signal de
prolifération et de survie (grâce à
ITAM et Igα/Igβ)
- Stimulation du récepteur :
Mécanisme d’apoptose
Processus d’editing
(production d’une nouvelle
chaine légère)
- Stimulation de
l’immunoglobuline
(plasmocytes, Ȼ mémoires)
- Sécrètent Ac ou Ig
solubles
milieu vasculaire ou
extravasculaire
- Ig présente 2 paratopes.
Lymphocytes T
Généralités
Lymphopoïèse T
Récepteurs T (TCR)
- Support majeur de l’immunité adaptative
(spécificité de la réponse à un Ag) régulateur clef de
la réponse immunitaire
- Rôle dans l’immunité innée (petite fraction d’entre
eux)
- 80-85% des lymphocytes circulants
- Se développe au sein du thymus majoritairement
- Précurseur hématopoïétique médullaire thymocyte
LT
- Toute Ȼ exprimant CD3 est un LT
- Chez individu sain, tissus stériles LT rencontrent
plutôt antigène du soi
- TCD8+ = killer, TCD4+ =soutien, aident les autres Ȼ
Maturations
Interactions LT/environnement
Ontogénie du LT
- 2 grandes variétés : TCR γδ / TCR
αβ
- Doivent être lié au CD3 pour être
efficace
- Reconnaissent un Ag seulement s’il
est en association avec une molécule
de CMH
- Jamais sécrétés
- Jamais reconnus sous forme soluble
- Réarrangement des gènes codants
- Peuvent exprimer 2 chaines α ≠
- Pas de communication isotypique
- Dégradation de l’Ag + manipulation =
CPA
- Des pro-T aux simples positifs : DN1 (CD44+,
CD117+) DN2 (CD3+, CD25+, CD 44+,
CD117+, Rag1 et 2 +) DN3 (CD3, CD25+,
TCRβ, Pré-Tα) DN4 (chaines α+β du récepteur)
double positif DP (CD4+, CD8+, TCRαβ)
Simple positif (SP) = soit le lymphocyte exprime
CD4+ ou CD8+
- Lymphocytes T γδ = bifurcation entre DN2 et
DN3
une fraction des Ȼ DN2 = pas de programme de
réarrangement mais réarrangement du locus γδ
La moitié des γδ n’expriment ni CD4 ni CD8
(= doubles négatifs DN), l’autre moitié est SP
(CD4 ou CD8)
- Etapes allant du précurseur au DN2 =
réversibles, à partir de DN3 = irréversibles
- Circulation intra-thymique :
DN1 dans la médullaire
DN2, DN3…. dans la corticale
Stade SP = Ȼ revient dans la médullaire où
elle trouve les vaisseaux nécessaires à son départ
C’est dans la corticale où se trouvent les Ȼ qui
éduquent les T à la reconnaissance « soi »/ « non-
soi »
- Interaction faisant intervenir Notch :
NOTCH (3 types) = récepteurs à la surface de la ȻT
Reconnaissent deux ligands à la surface des Ȼ
épithéliales : jagged et δ si interaction entre les 2 =
changement de conformation du Notch = accessible à
γsécrétase dans sa portion proche de la mb clivage Notch
en 2 parties, cytoplasmique et nucléaire (= facteur de
transcription qui active la différenciation de LT)
Si absence dans thymus LB et non LT.
Leucémie aigue lymphoblastique = mutation Notch
- Interaction récepteur T/ complexe CMH : plusieurs
devenir du thymocyte
Si LT incapable de reconnaitre CMH = mort du
thymocyte
Si capable d’interagir avec CMH :
Forte avidité du récepteur T apoptose
Avidité modérée LT anergique (état de
silence)
Avidité faible thymocyte survient
95-97% des thymocytes meurent avant
d’atteindre la maturité, soit par
développement défectueux, soit par
sélection négative
- Chez le fœtus, les 1er LT sont des LT γδ (9ème semaine)
petite fraction des lymphocytes circulants (10%), en
dehors de la rate, un peu partout (1-2%)
- LT βα = 10ème semaine plus de 90% de lymphocytes
circulants, partout dans l’organisme
- ≠ phénotypes :
Simple positif CD4+ = très minoritaire
Simple positif CD8+ = 30-50% de LT γδ
Double négatif = 50% des lymphocytes
- Marqueurs :
LT activé = CD25 (récepteurs à IL2), CMHII,
CD40L
CTL au repos = CMHI
LT naïfs (n’ont jamais rencontré d’Ag)= CD45 RA
LT mémoires = CD45 RO
Classification des LT
- Selon la morphologie : petits lymphocytes arrondies/
grands lymphocytes à grains LGL
- Selon l’expression CD4/ CD8 : la majorité des LT
périphériques sont des simple positifs (2/3 LTCD4 ; 1/3
CD8).
Ǝ LT double négatif (<5%) et LT double positif (<1%)
- Selon l’expression du récepteur : LTβα/ LTγδ
- Selon la fonction :
Conventionnels (majoritaire) / non-conventionnels
(immunité innée = TCR invariant, T-NK, MAIT)
LT auxiliaires : TH1 (exprime IL2 + INFγ), TH2
(IL4/IL5), TH17 (IL7 = pro-inflammatoire)n TH0
(lymphocyte helper, IL2, IL4, IL5, INFγ) = partout dans
l’organisme ; TFH (folicules primaires et secondaires,
exprime CD4+/CXCR5)
LT cytotoxiques (CTL) : destruction de manière
spécifique une Ȼ cible (infectée tumorale, étrangère).
Agissent grâce à mécanisme exocytose
dépendant/indépendant
LT régulateurs (peuvent devenir LT actifs) : LT
régulateurs naturel (TREG) ou LT régulateurs induits
en périphérie (TH3, Tr1)

4
Philippe Pulwermacher-Blanchard
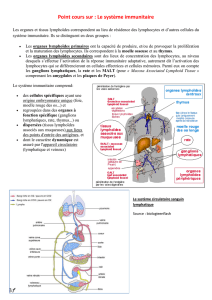
IV) Les organes lymphoïdes
Généralités
- 2 types d’organes lymphoïdes
Primaire (rôle dans la différenciation et la maturation) :
Fœtus : foie, rate, MO, thymus
Adulte : MO, Thymus
Secondaire (élaboration des réponses aux Ag étrangers) : les lymphocytes font 2 fois/ jour le tour de ces structures
- Lymphopoïèse = phénomène continu qui dure toute la vie +++
Organes
lymphoïdes Iaire
MO
Thymus
- Os plats spongieux (sternum, vertèbres, côtes et os iliaques)
- Charpente réticulaire
- Ȼ hématopoïétiques (Ȼ souches, PN, monocytes, érythroblastes, lymphocytes, mégacaryocytes)
- Ȼ stromales
- Adipocytes
- Organe bilobé dans le médiastin antérieur
- Principal siège de la lymphopoïèse T +++
- Involution lente (20-30 ans = reliquat thymique)
- Composition cellulaire :
Ȼ lymphoïdes (LT sous forme de thymocytes, LB minoritaires)
Ȼ dendritiques
Ȼ épithéliales
Développement + éducation LT
Parfois regroupées en amas = corpuscules de Hassal (dans la médullaire) proviennent de la mort
cellulaire épithéliale (autophagie)
- Vascularisation riche +++
Organes
lymphoïdes
IIaire
Ganglions
Rate
Tissu lymphoïde
Autres organes lymphoïdes IIaire
- Structure nodulaire < 1 cm
- Cortex superficiel (LT, Ȼ dendritiques)
- Cortex profond :
Follicules primaires (LB+++, LT, Ȼ dendritiques)
Follicules secondaires ou centre germinatifs :
proviennent des follicules primaires après stimulation
par un Ag
Vaisseaux sanguins afférents HEV = permettent
arrivée des Ȼ immunitaires
- Médullaire (LB+++, plasmocytes, macrophages, Ȼ
dendritiques+++)
- Hile : vaisseaux lymphatiques efférents, vaisseaux
sanguins afférents et efférents
- 150 g
- Pulpe rouge +++
- Artère + veine spléniques (ou liénales)
- Vaisseaux lymphatiques
- Capsule fine
- Interface de plusieurs m² (entre épithélium/environnement
extérieur) = lymphocytes intra-épithéliaux + qq mastocytes
- Pas de Ȼdendritiques au sein de l’épithélium
- Ȼ M entrée des cellules dans la lumière par pinocytose ainsi
que des Ag endoluminaux (transférés aux Ȼ dendritiques)
- Dans la muqueuse = follicules primaires (peuvent devenir
follicules secondaires)
Du duodénum à l’iléon, on trouve les plaques de Peyer, de
taille et nombre variable (2-300). Elles sont de structures
analogues aux ganglions mais sans vaisseaux lymphatiques
afférents
- Bronches
- Glandes mammaires
- Glandes lacrymales
- TD (plaques de Peyer, appendice)
- Amygdales
- Cercle de Waldeyer (oropharynx)
- Au niveau de la peau mais absents au
niveau du SNC
- Ǝ tissus lymphoïdes ectopiques
1
/
4
100%