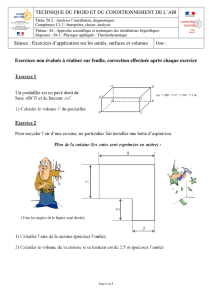
Le premier principe

Le premier principe
Réaction chimique – Semestre 1 – Thermochimie – Chapitre 2 Page 1
I] Enonce du premier principe, notion d’énergie interne U
Le premier principe de la thermodynamique, aussi appelé « principe de conservation de
l’énergie » affirme le caractère indestructible de l’énergie.
Un système fermé qui passe d’un état thermodynamique initial i à un état thermodynamique
finale f échange de l’énergie avec le milieu extérieur (énergie mécanique W et énergie calorifique Q).
Le premier principe affirme que la quantité d’énergie échangée sous forme de travail et de
chaleur, W + Q est constante quelque soit la façon dont la transformation est effectuée, elle n’a
pas pu être ni créée, ni détruite et est également à la variation de l’énergie du système appelée
« énergie interne ». Elle ne dépend que de l’état initial et de l’état final. Le premier principe se
traduit par la relation =+=.
U est la variation d’énergie interne du système au cours de la transformation. U représente
l’énergie « stockée » dans la matière et regroupe :
L’énergie cinétique microscopique due à l’agitation thermique des particules
L’énergie potentielle issue des forces interne au système (interaction
intermoléculaires et intramoléculaires)
L’énergie interne U est une fonction d’état (elle ne dépend que de l’état initial et de l’état
final). U peut varier à la suite d’échanges de matière et d’énergie avec le milieu extérieur ou à la suite
de processus internes au système. Il est pratiquement impossible de la déterminer. On ne cherche
d’ailleurs pas à la connaître, puisque c’est sa variation U qui nous intéresse.
U d’un système passant d’un état i à un état f est la somme algébrique de toutes les
énergies échangées avec le milieu extérieur. = + = + =
Cas particuliers :
Si le système subit une série de transformations et revient à son état initial,
=+=
Dans un système isolé, il n’y a pas d’échange de matière ou de chaleur avec
l’extérieur : donc =. Conséquence : l’énergie de l’univers est constante.

Le premier principe
Réaction chimique – Semestre 1 – Thermochimie – Chapitre 2 Page 2
II] Vision chimiste du premier principe
Il ne faut pas perdre de vue le but de la thermochimie est de déterminer la quantité de
chaleur mise en jeu dans une réaction chimique. D’autre part, il est rare que la pression et le volume
d’un système chimique varient simultanément. En conséquence, nous étudierons les transformations
chimiques, soit à volume constant, soit à pression constante.
II-/ Transformation à volume constant, dite isochore
C’est la situation que l’on rencontre pour une réaction effectuée dans un récipient
indéformable et fermé (autoclave) ou pour des réactions entre solide et/ou liquides (V y est négligé
du fait que les phases sont condensées).
Q, à volume constant est noté QV.
Puisque la variation de volume dV est nulle et que dW = -PdV = 0, dU = dQV + dW = dQV.
= = .
La quantité de chaleur mise en jeu dans une réaction chimique réalisée à volume constant,
est égal à la variation d’énergie interne du système = .
Remarque : les physiciens parlent de transformation isotherme si le système reste à
température constante, sans se préoccuper du système extérieur. Pour la réaction chimique, il y a
une nuance : c’est la température extérieure que l’on considère constante ; on parle de
transformation monotherme.
II-/ Transformation à pression constante, dite monobare
C’est le cas le plus courant : la réaction chimique est effectuée dans un récipient ouvert, à la
pression atmosphérique.
Q, à pression constante, est noté QP.

Le premier principe
Réaction chimique – Semestre 1 – Thermochimie – Chapitre 2 Page 3
Le travail est le travail des forces de pression :
=
=
= =
Alors, la variation d’énergie interne est :
=+ = + + + =
Comme = = (transformation monobare), + + =
On reconnaît dans cette expression une nouvelle fonction d’état : U + PV
C’est la fonction enthalpie : H = U + PV
Ici, = , soit =
La quantité de chaleur mise en jeu dans une réaction chimique effectuée à pression
constante est égale à la variation d’enthalpie du système.
Remarque : Les physiciens parlent de transformation isobare si le système reste à pression
constante, sans se préoccuper du système extérieur. Pour la réaction chimique, il y a une nuance :
c’est la pression extérieure que l’on considère constante ; on parle alors de transformation
monobare.
III] Conclusion, loi de Hess (1840)
C’est l’application chimiste du premier principe ; elle permet de déterminer aisément les
chaleurs de réaction.
La chaleur mise en jeu au cours d’une série de transformations chimiques ne dépend que de
l’état initial et de l’état final, à condition que toutes les réactions aient lieu soit à volume constant,
soit à pression constante.
On est donc amené à considérer deux types de « chaleurs de réaction » QP ou QV, mais nous
allons montrer, dans le chapitre suivant, qu’elles ne sont différentes que si des gaz participent à la
réaction.
Si QP ou QV sont positives, la réaction est « endothermique » ; le système gagne de l’énergie
calorifique au cours de la réaction. Par exemple, si on met les mains sur les parois d’un bécher où
vient de s’effectuer une réaction endothermique, on constate que celui-ci est plus froid. Un
thermomètre plongé dans le bécher affichera une chute de température.
Si QP ou QV sont négatives, la réaction est « exothermique » ; le système perd de l’énergie
calorifique au cours de la réaction. Si on met les mains sur les parois d’un bécher où vient de
s’effectuer une réaction exothermique, on constate que celui-ci est plus chaud. Un thermomètre
plongé dans un bécher affichera une augmentation de température.
1
/
3
100%