0Physique – Chimie DS n°6 – corrigé 1S

0Physique – Chimie DS n°6 – corrigé 1S
Exercice 1 : Bilan carbone avion vs voiture à essence
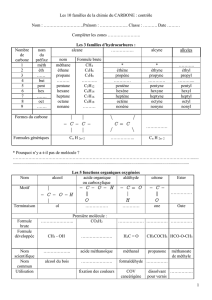
1. Alcanes :
a) La molécule ci-contre se nomme 2,3,5-triméthylhexane (3
groupes méthyle (1 carbone) sur les carbone 2, 3 et 5 ; la
chaîne la plus longue comporte 6 carbone : c'est donc hexane)
b) La formule semi-développée du 3-éthyl-2-méthylpentane est :
5 atomes de carbone dans la
chaîne la plus longue ; 1
groupe éthyle (2 carbones) sur
le 3ème carbone et 1 groupe méthyle sur le 2ème carbone.
c) Deux molécules sont isomères lorsqu’elles ont
même formule brute mais des formules
développées et semi-développées différentes.
La formule brute de l'octane est C8H2x8+2 c'est à
dire C8H18. La formule brute de la molécule a) est C9H20 et n'est donc pas isomère de l'octane.
La formule brute de la molécule b) est C8H18 : elle est donc isomère de l'octane.
2. Combustion des alcanes :
a) Lors de la combustion des alcanes, l'énergie chimique est convertie en énergie
thermique et en énergie de rayonnement.
b) Équation : C8H18 +
25
2
O2 → 8 CO2 + 9 H2O. On multiplie les nombres stœchiométriques par
2 pour qu'ils soient tous entiers : 2 C8H18 + 25 O2 → 16 CO2 + 18 H2O
c) M = 8 x 12,0 + 18 x 1,0 = 114,0 g.mol-1 ; m = ρ x V avec m en kilogramme car V est en L. Il faut
donc le multiplier m par 103 pour la convertir en g.
ness=m
M=ρ×V
M=0,74×0,135.103
114,0 =0,88mol
avec 2 CS ; La quantité de matière de carburant
consommé par kilomètre parcouru est de 0,88 mol.
d) Il y a plusieurs façons de faire : soit avec un tableau d'avancement, soit, méthode beaucoup
plus rapide, utiliser la stœchiométrie de l'équation de la réaction : pour une mole d'essence
consommée, 8 moles de CO2 sont émises. Donc nCO2 = 8 ness ; mCO2 = nCO2 x MCO2 = 8 x ness x
MCO2 = 8 x 0,88 x (12,0 + 2x16,0) = 8 x 0,88 x 44,0 = 3,1.102 g (2CS). La masse de CO2
formé par kilomètre parcouru est de 3,1.102 g.
e) pour la voiture : m1 = 2 x 800 x 3,1.102 / 2 = 2,5.105 g. La masse de dioxyde de carbone
produit par personne lors d'un trajet aller-retour Paris-Marseille, effectué par deux
personnes dans un véhicule 4x4 à essence est de 2,5.105 g.
Pour l'avion : m2 = 2 x 800 x 35.103 / 300 = 1,9.105 g. La masse de dioxyde de carbone
produit par personne lors d'un trajet aller-retour Paris-Marseille, effectué pour un avion
embarquant 300 passagers est de 1,9.105 g.
f) Dans les conditions du calcul, c'est l'avion qui minimise l'émission de dioxyde de
carbone.
3. Liquide de refroidissement :
a) Cette molécule appartient à la famille des alcools car elle comporte 2 groupements
hydroxyle (-OH)
b) Dans la nomenclature officielle, cette molécule est nommée éthan-1,2-diol : « di » car 2
groupements -OH ; « ol » car groupement -OH ; « éthan » car 2 carbones sur la chaîne
carbonée ; « 1,2 » car les groupements -OH sont sur les atomes de carbone n°1 et 2.
c) L'alcane contenant le même nombre d'atomes de carbone que l'éthylène glycol se nomme
éthane.
d) Formule semi-développée de l'éthanol :
e) Les groupes hydroxyle sont responsables de la formation de liaisons H entre les
molécules. Plus le nombre de groupes hydroxyle est important, plus les liaisons H sont
nombreuses et les températures de changement d’état sont élevées. Ainsi, la
température d’ébullition de l’éthane-1,2-diol (198°C) est plus élevée que celle de l’éthanol
(79°C), elle-même plus élevée que celle de l’éthane (-89°C).
f) La température d’ébullition de l’éthane-1,2-diol étant plus élevée que celle de l’eau, le
liquide ne se vaporise pas au contact des moteurs.
123456
2
3
45
1

4. Distillation fractionnée du pétrole brut : Les composants qui se vaporisent en premier
sont ceux qui ont la température d'ébullition la plus basse. Les gaz (< 0°C) sont donc
recueillis à l'étage supérieur (n°4), les essences (entre 150 et 200°C) à l'étage n°3, le
kérosène (entre 200 et 300°C) à l'étage n°2 et le fioul domestique (entre 300 et
400°C) à l'étage n°1.
Exercice 2 : Un service au tennis
1. ΔEp = EpB – EpD = mgyB - mgyD donc Δep = - mgH car yB = 0 et yD = H ; ΔEp= - 58,0.10-3 x 9,81 x
2,20 = - 1,25 J. La variation de l'énergie potentielle de la balle entre l'instant où elle quitte la
raquette et l'instant où elle touche le sol est de – 1,25 J. Son signe est négatif car l'énergie
potentielle diminue au cours du mouvement : en effet, la balle perd de l'altitude.
2. EcD = ½ mv0² avec EcD en J, m en kg et v0 en m.s-1.
3. EMD = EcD + EpD = ½ mv0² + mgH ; de même, EMB= EcB + EpB = ½ mvB² + 0 = ½ mvB²
4. L'énoncé précise que les frottements de l'air sont négligés. Donc en l'absence de frottements
l'énergie mécanique se conserve au cours du mouvement, donc EMD = EMB.
5. EMD = EMB donc ½ mv0² + mgH = ½ mvB² ; v0² + 2gH = vB² donc
vB=
√
v0
2+2gH
. Attention aux
unités : des conversions sont nécessaires !
vB=
√
126
3,6
2
+2×9,81×2,20=36,6m.s−1=128km.h−1
Lorsque la balle frappe le sol, sa vitesse est de 128 km.h-1 et est donc légèrement supérieure à
la vitesse initiale.
6. Les frottements de l'air vont ralentir la balle, donc la vitesse réelle de la balle sera inférieure à
la valeur calculée à la question 5.
Exercice 3 : Transfert d'énergie dans un circuit électrique
1. P = U x I = 4,5 x 100.10-3 = 0,45 W. La puissance électrique du moteur est de 0,45 W.
2. motrice TGV 1,0 W
lampe basse consommation 2,6 kW
sèche-linge 10 W
téléphone mobile 8,8 MW
3. Ee = P.Δt = 0,45 x 2,5 = 1,1 J. L'énergie électrique reçue par le moteur est de 1,1 J.
4. Le moteur possède une résistance interne r. Eth = r.I².Δt = 2,1 x (100.10-3)² x 2,5 = 5,3.10-2 J.
L'énergie perdue par effet Joule est de 5,3.10-2 J.
5. E1 = Ee - Eth = 1,1 - 5,3.10-2 = 1,0 J. (1 chiffre après la virgule). L'énergie pouvant être convertie en
énergie mécanique est de 1,0 J.
6. Chaîne énergétique associée au moteur :
7.
η= ξutile
ξreçue
=ξ1
ξe
=1,0
1,1 =0,91
Le rendement de conversion de ce moteur est de 91 %.

Physique – Chimie DS n°6 – corrigé * 1S
Exercice 1 : Bilan carbone avion vs voiture à essence
5. Alcanes :
a) La molécule se nomme 2,3,5-triméthylheptane (3
groupes méthyle (1 carbone) sur les carbone 2, 3
et 5 ; la chaîne la plus longue comporte 7 carbone :
c'est donc heptane)
b) La formule semi-développée du 4-éthyl-2,3,3-triméthylhexane est :
6 atomes de carbone dans la chaîne la plus longue ; 1
groupe éthyle (2 carbones) sur le 4ème carbone et 3
groupes méthyle : 1 sur le 2ème carbone et 2 sur le 3ème
carbone.
c) Deux molécules sont isomères lorsqu’elles ont même formule brute mais des formules
développées et semi-développées différentes. La formule brute du décane est C10H2x10+2
c'est à dire C10H22. La formule brute de la molécule a) est C10H22 et est donc isomère du
décane. La formule brute de la molécule b) est C11H24 : elle n'est donc pas isomère du
décane.
6. Combustion des alcanes :
a) Lors de la combustion des alcanes, l'énergie chimique est convertie en énergie
thermique et en énergie de rayonnement.
b) Équation : C10H22 +
31
2
O2 → 10 CO2 + 11 H2O. On multiplie les nombres stœchiométriques
par 2 pour qu'ils soient tous entiers : 2 C10H22 + 31 O2 → 20 CO2 + 22 H2O
c) M = 10 x 12,0 + 22 x 1,0 = 142,0 g.mol-1 ; m = ρ x V avec m en kilogramme car V est en L. Il
faut donc le multiplier m par 103 pour la convertir en g.
ness=m
M=ρ×V
M=0,80×14.103
142,0 =79mol
avec 2 CS ; La quantité de matière de carburant
consommé par kilomètre parcouru est de 79 mol.
d) Il y a plusieurs façons de faire : soit avec un tableau d'avancement, soit, méthode beaucoup
plus rapide, utiliser la stœchiométrie de l'équation de la réaction : pour une mole de kérosène
consommée, 10 moles de CO2 sont émises. Donc nCO2 = 10 nker ; mCO2 = nCO2 x MCO2 = 10 x nker
x MCO2 = 10 x 79 x (12,0 + 2x16,0) = 10 x 79 x 44,0 = 35.103 g (2CS). La masse de CO2 formé
par kilomètre parcouru est de 35 kg.
e) Pour l'avion : m2 = 2 x 800 x 35.103 / 300 = 1,9.105 g. La masse de dioxyde de carbone
produit par personne lors d'un trajet aller-retour Paris-Marseille, effectué pour un avion
embarquant 300 passagers est de 1,9.105 g.
pour la voiture : m1 = 2 x 800 x 3,1.102 / 2 = 2,5.105 g. La masse de dioxyde de carbone
produit par personne lors d'un trajet aller-retour Paris-Marseille, effectué par deux
personnes dans un véhicule 4x4 à essence est de 2,5.105 g.
f) Dans les conditions du calcul, c'est l'avion qui minimise l'émission de dioxyde de
carbone.
7. Liquide de refroidissement :
a) Cette molécule appartient à la famille des alcools car elle comporte 2 groupements
hydroxyle (-OH)
b) Dans la nomenclature officielle, cette molécule est nommée éthan-1,2-diol : « di » car 2
groupements -OH ; « ol » car groupement -OH ; « éthan » car 2 carbones sur la chaîne
carbonée ; « 1,2 » car les groupements -OH sont sur les atomes de carbone n°1 et 2.
c) L'alcane contenant le même nombre d'atomes de carbone que l'éthylène glycol se nomme
éthane.
d) Formule semi-développée de l'éthanol :
e) Les groupes hydroxyle sont responsables de la formation de liaisons H entre les
molécules. Plus le nombre de groupes hydroxyle est important, plus les liaisons H sont
nombreuses et les températures de changement d’état sont élevées. Ainsi, la
1234567
12
3
456

température d’ébullition de l’éthane-1,2-diol (198°C) est plus élevée que celle de l’éthanol
(79°C), elle-même plus élevée que celle de l’éthane (-89°C).
f) La température d’ébullition de l’éthane-1,2-diol étant plus élevée que celle de l’eau, le
liquide ne se vaporise pas au contact des moteurs.
8. Distillation fractionnée du pétrole brut : Les composants qui se vaporisent en premier
sont ceux qui ont la température d'ébullition la plus basse. Les gaz (< 0°C) sont donc
recueillis à l'étage supérieur (n°4), les essences (entre 150 et 200°C) à l'étage n°3, le
kérosène (entre 200 et 300°C) à l'étage n°2 et le fioul domestique (entre 300 et
400°C) à l'étage n°1.
Exercice 2 : Un service au tennis
1. ΔEp = EpB – EpD = mgyB - mgyD donc Δep = - mgH car yB = 0 et yD = H ; ΔEp= - 57,0.10-3 x 9,81 x
2,30 = - 1,29 J. La variation de l'énergie potentielle de la balle entre l'instant où elle quitte la
raquette et l'instant où elle touche le sol est de – 1,29 J. Son signe est négatif car l'énergie
potentielle diminue au cours du mouvement : en effet, la balle perd de l'altitude.
2. EcD = ½ mv0² avec EcD en J, m en kg et v0 en m.s-1.
3. EMD = EcD + EpD = ½ mv0² + mgH ; de même, EMB= EcB + EpB = ½ mvB² + 0 = ½ mvB²
4. L'énoncé précise que les frottements de l'air sont négligés. Donc en l'absence de frottements
l'énergie mécanique se conserve au cours du mouvement, donc EMD = EMB.
5. EMD = EMB donc ½ mv0² + mgH = ½ mvB² ; v0² + 2gH = vB² donc
vB=
√
v0
2+2gH
. Attention aux
unités : des conversions sont nécessaires !
vB=
√
128
3,6
2
+2×9,81×2,30=36,2m.s−1=130km.h−1
Lorsque la balle frappe le sol, sa vitesse est de 130 km.h-1 et est donc légèrement supérieure à
la vitesse initiale.
6. Les frottements de l'air vont ralentir la balle, donc la vitesse réelle de la balle sera inférieure à
la valeur calculée à la question 5.
Exercice 3 : Transfert d'énergie dans un circuit électrique
1. P = U x I = 4,5 x 100.10-3 = 0,90 W. La puissance électrique du moteur est de 0,90 W.
2. téléphone mobile 2,6 kW
motrice TGV 1,0 W
lampe basse consommation 10 W
sèche-linge 8,8 MW
3. Ee = P.Δt = 0,90 x 3,5 = 3,2 J. L'énergie électrique reçue par le moteur est de 3,2 J.
4. Le moteur possède une résistance interne r. Eth = r.I².Δt = 3,2 x (200.10-3)² x 3,5 = 0,45 J.
L'énergie perdue par effet Joule est de 0,45 J.
5. E1 = Ee - Eth = 3,2 – 0,45 = 2,8 J. (1 chiffre après la virgule). L'énergie pouvant être convertie en
énergie mécanique est de 2,8 J.
6. Chaîne énergétique associée au moteur :
7.
η= ξutile
ξreçue
=ξ1
ξe
=2,8
3,2=0,88
Le rendement de conversion de ce moteur est de 88 %.
1
/
4
100%