TP 3 - Anne CURK

TP 3 : SEPARATION DES PRODUITS DE LA REACTION DE CANNIZZARO
Révisions de techniques de chimie organique.
Objectifs :
On fournit un mélange de benzaldéhyde et de potasse (hydroxyde de potassium solide) qui ont réagi pendant
une semaine environ selon la réaction de Cannizzaro :
2 C
6
H
5
-CHO + HO
-
C
6
H
5
-COO
-
+ C
6
H
5
-CH
2
-OH
Nous nous proposons d’utiliser différentes techniques pour séparer et purifier les
deux
produits de la réaction.
Données :
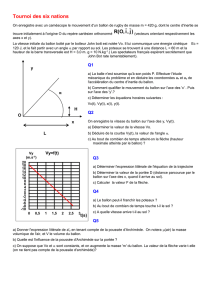
• Annexe 1 : Courbes d’équilibre liquide-vapeur
• Annexe 2 : Données de sécurité
• Annexe 3 : Table de données de spectroscopie IR (commune à tous les TP)
Produits et matériel à disposition :
Produits :
• Acide chlorhydrique concentré • Ether (Et
2
O)
• Mélange réactionnel de la réaction de Cannizzaro • Sulfate de magnésium anhydre
Matériel :
• Ampoule à décanter de 500 mL
• Béchers : 1 de 800 mL et 1 de 250 mL
• Fiole à vide, pompe, filtre Büchner et papier filtre
• Agitateur magnétique chauffant
• Banc Koffler et produits étalons
• Agitateur en verre, spatule
• Poste de distillation sous pression réduite :
- Ballons : 1 de 250 mL, 4 de 100 mL
- Colonne de distillation
- Réfrigérant droit
- Séparateur de Pauly
- Flacon de garde
- Trompe à vide
- Chauffe ballon et support élévateur
- Sonde de température
- Manomètre
Travail à effectuer pendant la séance :
Question 1 :
A quel type de réaction appartient la réaction de Cannizzaro ? Justifier. Proposer un mécanisme
réactionnel. (De façon tout à fait exceptionnelle, un hydrure ( issu de C – H ) doit bouger au cours de ce mécanisme).
I. Séparation des deux produits
Question 2 : Quelle différence faites-vous entre "séparation des deux produits" et "extraction d'un produit" ?
Voir fiche extraction / lavage pour réviser la technique et son intérêt.
Le mélange réactionnel (pâte blanche) est contenu dans un erlenmeyer fermé au papier paraffiné. La potasse est très
corrosive : mettre lunettes de protection et des gants, et éviter toute éclaboussure.
a) Dissoudre à l'aide d’une baguette en verre le mélange solide dans environ 250 mL d’eau du robinet directement
versé dans l'erlenmeyer du mélange. Quelques morceaux de solide résiduel au fond ne gênent pas. Les laisser au fond
si nécessaire pour aborder la suite rapidement.
b) L'éther étant très inflammable vérifier qu’aucune flamme ou source de chaleur ne se trouve à proximité.
c) Prendre une ampoule à décanter et vérifier que le robinet est bien graissé puis y verser toute la solution aqueuse.
d) Extraire l'alcool benzylique à l'aide de deux portions d'éther (volume équivalent à environ 1 petit cm dans
l'ampoule à décanter). AVANT de procéder, réfléchir à l'intérêt de l'opération et à son déroulement. En cas de
doute, interroger votre professeur.

II. Purification de l'alcool benzilique
a) Sécher la phase organique sur sulfate de magnésium anhydre puis éliminer l’éther à l’évaporateur rotatif
(rotavapor).
Question 3 : Pourquoi cette opération de séchage est-elle nécessaire ? Que reste-t-il dans le ballon à la fin de
l'opération –évaporation sous vide- ?
Si il y a trop d’attente à l’évaporateur rotatif, chercher l'exercice au verso de la fiche extraction / lavage, puis si
nécessaire passer directement au III.
b) Regrouper les fractions organiques avec celles d’un autre binôme puis procéder à la distillation sous vide
décrite à partir du point c) .
Si il y a trop d’attente au poste de distillation, analyser le schéma de l'annexe 1. Définir la pression de vapeur saturante
et déduire de ce schéma les températures standards d'ébullition de tous les produits mentionnés, justifier la nécessité
d'une distillation sous vide pour certains produits. Si le poste n'est toujours pas libre finir l'exercice, et
passer
directement au III.
c) Verser la phase organique résiduelle dans le ballon de distillation sous-vide du montage reproduit ci-après.
Brancher la réfrigération (circulation d'eau au robinet en façade de votre paillasse) et le chauffe ballon. Allumer la sonde
de température et de pression (en façade de paillasse). Fermer le robinet au dessus du flacon de garde pour procéder à
la distillation sous vide. Allumer le chauffage. La trompe à vide impose la pression que vous lirez pendant que le distillat
est recueilli. Cette pression risque d'évoluer pendant que le distillat passe, de même que la température lue en sortie de
colonne.
d) Numérotez les ballons du séparateur de Pauly.
e) Les premières gouttes de distillat seront recueillies dans un ballon du séparateur de Pauly. Noter la température
en haut de la colonne lors de l’apparition de ces premières gouttes ainsi que le numéro du ballon dans lequel elles sont
recueillies. Tant que la température est à peu près stable en haut de la colonne, continuer de recueillir le distillat dans le
même ballon. Dès que la température évolue à nouveau, tourner le séparateur pour recueillir le distillat dans un
nouveau ballon. Et ainsi de suite … jusqu’au dernier ballon si nécessaire. Noter les domaines de température
correspondant à chaque ballon.
f) Arrêter le chauffage avant que le ballon de distillation soit totalement vide (2 cm de diamètre de liquide au
fond). Rouvrir alors le robinet de mise en pression atmosphérique du flacon de garde et seulement ensuite fermer la
trompe à vide.
g) En vous aidant de l’annexe 1, identifier le ballon contenant l’alcool benzylique. Répondre à la question 6.
h) Pour pouvoir confirmer la caractérisation du distillat comme étant de l'alcool benzylique pur, tracer le spectre IR
de la fraction retenue. Analyser ce spectre IR : raies attendues , raies significatives d'impuretés
Schéma du montage de distillation sous pression réduite

III. Purification de l'acide benzoïque
Question 4 : Quel est le contenu de la phase aqueuse résiduelle de l'extraction? Justifier le point a) suivant. Justifier
que la phase soit limpide.
a) Remettre des gants ( étant acquis que les lunettes sont sur le nez ! )
b) Ajouter à la phase aqueuse, très lentement, en agitant, de l'acide chlorhydrique concentré : un précipité blanc
apparaît. Arrêter l'addition lorsque le pH est très acide (vérifié au papier pH). Le précipité est très abondant.
Question 5 : Pourquoi le changement de pH fait-il apparaître un précipité ? Écrire la réaction chimique associée En
déduire une méthode générale d'extraction, puis obtention d'un acide carboxylique à partir d'un milieu organique. Par
extrapolation, en déduire une méthode d'extraction, puis obtention d'une amine à chaîne carbonée importante.
Toutefois, il s'avère qu'en ajoutant le milieu prévu pour l'extraction, un précipité contenant l'amine souhaité apparaisse.
Comment est-ce possible?
c) Préparer le poste de filtration sur Büchner ( papier filtre ). Filtrer le précipité sur Büchner en versant le contenu du
bécher petit à petit (verser beaucoup de mélange à la fois colmate le papier filtre).
d) Procéder à la recristallisation de 5 à 10 g de ce précipité : ( Voir fiche recristallisation pour réviser la technique )
- Préparer le montage nécessaire à la recristallisation.
- Déposer la masse m (connue précisément) à recristalliser dans le ballon et ajouter un minimum d’eau
distillée (volume suffisant pour recouvrir le solide).
- Porter à ébullition douce.
- Lorsque l’ébullition est atteinte, rajouter par le haut du réfrigérant, si nécessaire, de petites quantités d’eau
distillées pour obtenir la dissolution complète à ébullition. Attendre la reprise de l’ébullition entre chaque
ajout.
- Dès que la solution est limpide, baisser le chauffe ballon et laisser refroidir lentement.
- Lorsque le ballon est revenu à température ambiante, le plonger dans un cristallisoir de glace.
- Filtrer sur Büchner. Essorer les cristaux longuement.
e) Peser la masse de produit obtenu après la recristallisation. Calculer le rendement de la recristallisation.
f) Caractériser le produit par une prise du point de fusion sur le banc Koffler et le comparer à la température
attendue trouvée dans les tables.
g) Déposer le reste de produit solide brut (non recristallisé) dans le flacon marqué « acide benzoïque brut » et votre
produit recristallisé dans le flacon marqué « acide benzoïque recristallisé ».

A
NNEXE
1 : C
OURBES D
’
EQUILIBRE LIQUIDE
-
VAPEUR
Pression de vapeur saturante de différents composés en fonction de la température
A
NNEXE
2 : D
ONNEES DE SECURITE
Acide
benzoïque
H318 : Provoque des lésions oculaires graves.
H335 : Peut irriter les voies respiratoires.
Alcool
benzylique
H302 : Nocif en cas d’ingestion.
H332 : Nocif par inhalation.
Benzaldéhyde
H302 : Nocif en cas d’ingestion.
Ether
H224 : Liquide et vapeurs extrêmement inflammables.
H302 : Nocif en cas d’ingestion.
H336 : Peut provoquer somnolence ou vertiges.
Hydroxyde de
potassium
H290 : Peut être corrosif pour les métaux.
H302 : Nocif en cas d’ingestion.
H314 : Provoque des brûlures de la peau et des lésions oculaires
graves.
1
/
4
100%