Diastéréo-isomérie - Cours chimie organique - Gérard Dupuis -

Diastéréo-isomérie - Cours chimie organique - Gérard Dupuis - Lycée ... http://www.faidherbe.org/site/cours/dupuis/diaster.htm
1 sur 10 14/02/2007 17:57
Cours de chimie Organique - G. Dupuis - Lycée Faidherbe Lille
Diastéréo-isomérie
Définitions
La configuration d'une entité moléculaire est la disposition spatiale des atomes ou des groupes d'atomes de
cette entité. Ce terme est propre aux stéréo-isomères dont l'isomérie n'est pas due à des différences de
conformation.
Des diastéréo-isomères sont, par définition, des stéréoisomères de configuration non énantiomères.
Diastéréo-isomérie due à la présence d'une double liaison
Les configurations relatives autour d'une double liaison sont nommées en utilisant les stéréodescripteurs
Z, E obtenus à partir des règles de Cahn, Ingold et Prelog.
Double liaison carbone-carbone
La présence d'une liaison double entre deux atomes de carbone empêche la rotation des groupes autour de
l'axe de la liaison à la température ordinaire. Les acides (Z)-but-2-ène-1,4-dioïque et
(E)-but-2-ène-1,4-dioïque sont des diastéréo-isomères.
L'acide (E)-but-2-ène-1,4-dioïque ou fumarique existe à l'état
naturel dans certains végétaux (fumaria). On rencontre ses sels
dans plusieurs cycles biochimiques importants. Son hydratation
en acide L-malique sous l'action de l'enzyme fumarase constitue
l'une des étapes du cycle de Krebs. On rouve également ce
composé dans le cycle de l'acide citrique et celui de l'urée.

Diastéréo-isomérie - Cours chimie organique - Gérard Dupuis - Lycée ... http://www.faidherbe.org/site/cours/dupuis/diaster.htm
2 sur 10 14/02/2007 17:57
L'acide (Z)-but-2-ène-1,4-dioïque ou maléïque peut être obtenu
par isomérisation thermique de l'acide fumarique à une
température supérieure à 200 °C.
Un autre exemple est celui des diastéréo-isomères du but-2-ène.
Double liaison carbone-azote
La même nomenclature s'applique aux composés comportant une liaison double entre un atome de
carbone et un atome d'azote notamment les imines et les oximes. Un doublet non liant est classé comme
dernier prioritaire.
Pour des raisons historiques, les composés de stéréochimie Z sont souvent appelés syn et ceux de
stéréochimie E sont appelés anti.
Diastéréo-isomérie due à la présence d'un cycle
Le plan de référence est le plan moyen du cycle. Lorsque les substituants de plus grande priorité sont du
même côté de ce plan moyen, le composé est de stéréochimie Z ou cis. Lorsque ces substituants sont
situés de part et d'autre de ce plan, le composé est de stéréochimie E ou trans.
Il existe deux diastéréo-isomères dans la famille des (1,4)-diméthylcyclohexane :
dans l'isomère cis (conformations I et I'), les groupes méthyle sont du même côté du plan moyen du
cycle. Les conformations I et I' possèdent la même énergie ;
dans l'isomère trans (conformations II et II'), les groupes méthyle sont de part et d'autre du plan
moyen du cycle. La conformation II dans laquelle les deux substituants sont en position équatoriale
possède une énergie plus petite que la conformation II' dans laquelle ils sont en position axiale. La
conformation II est donc favorisée par rapport à II'.

Diastéréo-isomérie - Cours chimie organique - Gérard Dupuis - Lycée ... http://www.faidherbe.org/site/cours/dupuis/diaster.htm
3 sur 10 14/02/2007 17:57
Les molécules précédentes possèdent un plan de symétrie qui coupe le cycle en passant par les groupes
méthyle. Elles ne sont donc pas chirales.
Diastéréo-isomérie due à la présence de plusieurs centres chiraux
Absence de cycle
Puisqu'un atome de carbone asymétrique possède deux configurations, deux atomes de carbone
asymétriques conduiront au maximum à quatre stéréo-isomères. Les stéréoisomères du
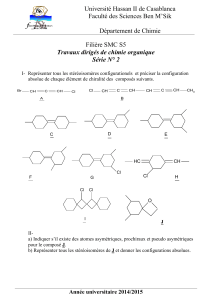
2-bromo-3-fluorobutane sont représentés ci-dessous. Ils sont nommés en utilisant les règles de Cahn,
Ingold et Prelog. Deux composés situés sur la même horizontale sont énantiomères. Deux composés non
situés sur la même horizontale sont diastéréo-isomères.
(2R, 3R)-2-bromo-3-fluorobutane (2S, 3S)-2-bromo-3-fluorobutane
(2R, 3S)-2-bromo-3-fluorobutane (2S, 3R)-2-bromo-3-fluorobutane
Le schéma ci-dessous précise les relations d'énantiomérie, symbolisées par E et de diastéréo-isomérie,
symbolisées par D.

Diastéréo-isomérie - Cours chimie organique - Gérard Dupuis - Lycée ... http://www.faidherbe.org/site/cours/dupuis/diaster.htm
4 sur 10 14/02/2007 17:57
les énantiomères (R, R) et (S, S) forment le couple like ;
les énantiomères (R, S) et (S, R) forment le couple unlike.
Lorsque deux atomes de carbone asymétriques sont substitués par des groupes identiques, le nombre de
stéréoisomères diminue car le nombre d'arrangements possible est plus petit.
Il n'existe que trois stéréoisomères de la famille des acides 2, 3-dihydroxybutanedioïque (acides
tartriques) :
les composés (2R, 3R) et (2S, 3S) énantiomères ;
un composé achiral de configuration absolue (2R, 3S) ou (2S, 3R), diastéréo-isomère des deux
précédents, appelé composé méso.
Dans la chimie des sucres, le décompte des stéréoisomères peut être facilité en utilisant la projection de
Fischer.
Epimères
Des diastéréoisomères qui ne diffèrent que par la configuration absolue d'un seul centre chiral sont
appelés des épimères. Lorsque le centre chiral en question est formé lors de l'hémiacétalisation d'un sucre,
on appelle ces épimères particuliers des anomères (du grec ano, en tête, et meros, partie.)
Présence d'un cycle
Nous allons examiner le cas des stéréo-isomères du (1,2)-diméthylcyclohexane. La molécule de
cis-(1,2)-diméthylcyclohexane est a priori chirale. En effet si on la regarde comme une structure figée,
elle n'est pas superposable à son image dans un miroir plan.
Cependant, à la température ordinaire, le basculement conformationnel égalise les populations des deux
énantiomères.

Diastéréo-isomérie - Cours chimie organique - Gérard Dupuis - Lycée ... http://www.faidherbe.org/site/cours/dupuis/diaster.htm
5 sur 10 14/02/2007 17:57
Les molécules dessinées à droite sont identiques (amener 1 en coïncidence avec 2' et 2 en coïncidence
avec 1'). Le cis-(1,2)-diméthylcyclohexane est un composé méso. Il s'agit du (1R,
2S)-1,2-diméthylcyclohexane.
Il existe d'ailleurs des conformations achirales de ce composé. Cela apparaît plus nettement en utilisant la
représentation de Cram I' de ce composé (plan de symétrie passant entre les atomes 1 et 2).
La molécule de cis-(1,2)-diméthylcyclohexane considérée comme une
structure figée, est chirale. A la température ordinaire les deux
énantiomères sont en équilibre rapide et un échantillon macroscopique du
composé est constitué d'un mélange racémique.
Les dessins ci-dessous représentent le (1S, 2S)-1,2-diméthylcyclohexane (figure I) et son énantiomère le
(1R, 2R)-1,2-diméthylcyclohexane (figure II) en utilisant successivement la représentation en perspective
et la représentation de Cram.
Le basculement conformationnel ne permet pas de passer d'un énantiomère à l'autre.
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%