D234 lequel oxyde reduit sept2007

D234 OXYDO-REDUCTION
LEQUEL OXYDE ? LEQUEL REDUIT ?
Adaptation : M. Casanova,M. Ulmann & H.Jenny CdC 2002 Conception :A Chanal Collège de Candolle 1999
- 1/4 - Mise à jour 05/10/07
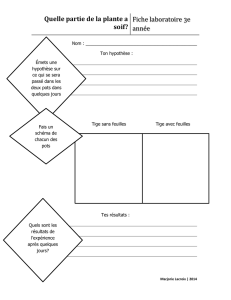
BUT
Effectuer une série de réactions de transferts d’électrons permettant de classer les
éléments selon leur force oxydante ou réductrice relative.
Comparer le pouvoir oxydant de différents cations métalliques
MATERIEL
8 éprouvettes
REACTIFS
A disposition (pupitre maître ; 2 postes): les solutions et pipettes
Produits (solutions aqueuses de) :
- nitrate d’argent (AgNO
3
0,02 M)
- dichlorure de zinc (ZnCl
2
1 M)
- sulfate de cuivre (CuSO
4
.5H
2
O 1 M)
- solution de Fe
II+
(Fe
II+
1 M)
Tiges : 3 de cuivre (Cu), 2 de fer (Fe), 1 de zinc (Zn), 2 d’argent (Ag)
RECOMMANDATIONS
Manipuler avec précaution les solutions de métaux.. Ne pas ingérer ou mettre
en contact avec la peau ou les yeux.
MANIPULATIONS
ET DISCUSSIONS
1. Préparation des couples : solution / tige métallique
Placer dans chaque éprouvette la solution et la tige de métal comme indiqué dans
le tableau ci-dessous :
Eprouvette Solution Tige de
1≈ 4ml (≈ 4 cm) ZnCl
2
Cu
2≈ 4ml (≈ 4 cm) CuSO
4
Zn
3≈ 4ml (≈ 4 cm) AgNO
3
Fe
4≈ 4ml (≈ 4 cm) Fe
II+
Ag
5≈ 4ml (≈ 4 cm) CuSO
4
Fe
6≈ 4ml (≈ 4 cm) Fe
II+
Cu
7≈ 4ml (≈ 4 cm) CuSO
4
Ag
8≈ 4ml (≈ 4 cm) AgNO
3
Cu
Compléter les tableaux du point 2 et laisser reposer les éprouvettes
20 minutes avant de noter vos observations

D234 lequel oxyde reduit sept2007.doc - 2/4 - Mise à jour 05/10/07
MANIPULATIONS
ET DISCUSSIONS
(suite)
2. Comparaisons et observations
a) Cuivre et zinc : comparer les éprouvettes correspondant au schéma ci-dessous
et compléter le tableau.
Eprouvette
N
o
Tige métallique
(symbole) Cation contenu
dans la solution Observations
Proposer l’équation de la réaction d’oxydo-réduction qui a lieu dans l’éprouvette où
l’on observe une transformation.
oxydation :
réduction :
_________________________________________________________________
Bilan :
Nous pouvons déduire que : le pouvoir oxydant du cation ______ est plus élevé
que celui du cation ______. C’est le cation ______ qui oxyde la tige de ________
b) Fer et argent : comparer les éprouvettes correspondant au schéma ci-dessous
et compléter le tableau.
Eprouvette
N
o
Tige métallique
(symbole) Cation contenu
dans la solution Observations
Proposer l’équation de la réaction d’oxydo-réduction qui a lieu dans l’éprouvette où
l’on observe une transformation.
oxydation :
réduction :
_________________________________________________________________
Bilan :
Nous pouvons déduire que : le pouvoir oxydant du cation ______ est plus élevé
que celui du cation ______. C’est le cation ______ qui oxyde la tige de ________
tige d’argent
solution de
ferII+
tige de fer
nitrate d’argent
tige de zinc
sulfate de cuivre
tige de cuivre
dichlorure de zinc

D234 lequel oxyde reduit sept2007.doc - 3/4 - Mise à jour 05/10/07
MANIPULATIONS
ET DISCUSSIONS
(suite)
c) Fer et cuivre : comparer les éprouvettes correspondant au schéma ci-dessous
et compléter le tableau.
Eprouvette
N
o
Tige métallique
(symbole) Cation contenu
dans la solution Observations
Proposer l’équation de la réaction d’oxydo-réduction qui a lieu dans l’éprouvette où
l’on observe une transformation.
oxydation :
réduction :
_________________________________________________________________
Bilan :
Nous pouvons déduire que : le pouvoir oxydant du cation ______ est plus élevé
que celui du cation ______. C’est le cation ______ qui oxyde la tige de ________
d) Argent et cuivre : comparer les éprouvettes correspondant au schéma ci-
dessous et compléter le tableau.
Eprouvette
N
o
Tige métallique
(symbole) Cation contenu
dans la solution Observations
Proposer l’équation de la réaction d’oxydo-réduction qui a lieu dans l’éprouvette où
l’on observe une transformation.
oxydation :
réduction :
_________________________________________________________________
Bilan :
Nous pouvons déduire que : le pouvoir oxydant du cation ______ est plus élevé
que celui du cation ______. C’est le cation ______ qui oxyde la tige de ________
tige de cuivre
solution de
ferII+
tige de fer
sulfate de cuivre
tige de cuivre
nitrate d’argent
tige d’argent
sulfate de cuivre

D234 lequel oxyde reduit sept2007.doc - 4/4 - Mise à jour 05/10/07
DISCUSSIONS
(suite)
Classer tous les couples redox de cette expérience selon leur force d’oxydation
croissante, sachant que le couple Zn
2+
/Zn a le pouvoir oxydant le plus faible.
Pouvoir oxydant croissant
Zn
2+
/Zn
Comparer si les observations expérimentales correspondent aux informations
théoriques mentionnées dans la liste des potentiels de réduction ci-jointe.
Couples redox
Potentiels redox E
o
[V]
Potentiels standards de réduction croissants [V]
TABLEAU RECAPITULATIF
Compléter le tableau ci-dessous avec vos résultats et à l’aide de la liste des
potentiels(ci-jointe)
M E T A L
Cation Fe Zn Cu Ag
Fe
2+
Zn
2+
Cu
2+
Ag
+
Est-ce que la réaction :
Pb
2+
+ Cu
→
Pb +
Cu
2+
est possible ? Justifier !
RECUPERATION
ET NETTOYAGE
Vider le contenu des éprouvettes dans le récipient métaux lourds.
Rincer la verrerie et les tiges utilisées à l’eau du robinet.
1
/
4
100%