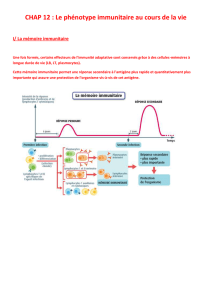
Effet de la vaccination intra-tumorale sur l`immunité anti

Effet de la vaccination intra-tumorale sur
l’immunité anti-tumorale
Romane Dussez, Lycée-Collège de la Planta, Sion
Sorina Vlad, Collège St-Michel, Fribourg
Supervision : Marion Humbert, Unige
Directrice de laboratoire : Pr. Stéphanie Hugues
Département de Pathologie et Immunologie

RESUME
Lors de notre semaine en laboratoire, nous avons étudié les cellules dentritiques
plasmacytoïdes (pDC) dans le contexte de l’immunité anti-tumorale. Nous avons tenté de
restimuler ces cellules, dont les fonctions sont inhibées par le microenvironnement anti-
tumoral au moyen d’un vaccin. Nous avons observé que lorsque nous injectons un vaccin
contenant un adjuvant ciblant spécifiquement les pDC et un antigène tumoral, il y a une
baisse de la croissance tumorale. Nos résultats ne nous permettent cependant pas de
déterminer si la baisse de la croissance de la tumeur est due à la réactivation de ces pDC
ou si d’autres cellules ont un rôle.
INTRODUCTION
Le système immunitaire est le mécanisme de défense de l’organisme contre les micro-
organismes nuisibles et les tumeurs.
Les lymphocytes T CD4+ ont besoin de cellules présentatrices d’antigènes (CPA) pour
détecter les micro-organismes nuisibles ou les cellules tumorales et enclencher la réaction
immunitaire adaptive.
Les CPA informent les lymphocytes T de la présence d’une infection ou d’une tumeur par
trois différents signaux (fig.1) :
1. La présentation d’antigène
2. La co-stimulation
3. L’émission de cytokines
fig1. La présentation d’antigène aux lymphocytes T

Parmi ces CPA, nous nous intéressons, dans notre recherche, à des cellules spécifiques,
les cellules dendritiques plasmacytoïdes (pDC). (fig.2)
fig.2 Les cellules dendritiques plasmacytoïdes
Cette étude porte sur le rôle des pDC dans le contexte de l’immunité anti-tumorale. Il est à
noter que le microenvironnement tumoral secrète des facteurs anti-inflammatoires qui
inhibent la réponse immunitaire. Les pDC ne peuvent donc plus remplir leurs fonctions de
CPA et induire une réponse immunitaire anti-tumorale.
L’objectif de cette recherche est de déterminer si les fonctions anti-tumorales des pDCs
peuvent être réactivées après vaccination intra-tumorale.
MATÉRIEL ET METHODES
En salle de culture :
Anesthésiant :
L’anesthésiant est composé de : 50% PBS (tampon de phosphate salin), 50% kétamine
(45%) et rompun (5%).
Cellules :
Nous utilisons la lignée EG7, qui est un lymphome exprimant la protéine OVA. La solution
des cellules (cellules tumorales + milieu de culture), se trouvant dans un flasque stérile,
est vérifiée à l’aide du microscope et on rajoute la généticine, qui est un antibiotique, afin
Endosome
TLR7
TLR9
Viral or self nucleic acids
ssRNA
DNA
NF-KB
IRF-
7
Type I IFNs
IL-6, TNF
CD4/8
+
T cell
pDC
DC licensing,
NK cells, B cells
Adaptive
immunity
Ag captured by endocytosis,
exosomes, membrane transfer
Innate
immunity

d’obtenir seulement des cellules exprimant OVA. En effet, les cellules qui expriment OVA
expriment aussi un gène de résistance à la généticine (R) et vont donc survivre à
l’antibiotique, tandis que les cellules n’exprimant pas OVA sont sensibles à l’antibiotique
(fig.3). Suite à ça, on transfère la solution dans des tubes de culture cellulaire, à l’aide
d’une pipette et on les centrifuge pendant 5 minutes. Avec une pipette pasteur et une
pompe à vide, on aspire le surnageant, le culot cellulaire restant au fond des tubes de
culture. Le PBS est rajouté, afin de diluer les cellules cancéreuses et de pouvoir passer au
comptage, à l’aide du quadrillage Neubauer. On rajoute de nouveau du PBS pour obtenir
la concentration de cellules souhaitée et ce qu’on obtient est la solution de cellules
tumorales EG7 que l’on va injecter aux souris.
fig.3 Expression d’un gène de résistance à la Généticine par les cellules EG7
A l’animalerie :
On dispose d’un total de 15 souris, C57Bl/6, qui sont séparées en 3x5. Avant de
commencer toute procédure, les souris doivent être anesthésiées. On injecte
l’anesthésiant dans le péritoine.
Puis, on rase le flanc gauche, et on injecte le lymphome EG7 en sous-cutané à chaque
souris.
Par la suite, notre tutrice injectera le vaccin dans les tumeurs. Cinq souris seront injectées
avec du PBS (contrôle), 5 souris avec du CpG-B seul (adjuvant ciblant spécifiquement les
pDC) et 5 souris avec CpG-B en présence d’OVAII (antigène tumoral reconnu par les
lymphocytes T CD4+).
RESULTATS
On constate une baisse de la croissance tumorale suite aux injections des vaccins. On
remarque qu’en présence de CpG-B et l’antigène OVAII, la taille des tumeurs s’est
stabilisée. Quant à l’injection avec du PBS, la croissance a continué de manière
exponentielle, car ce n’est qu’un contrôle et pas un vaccin thérapeutique.
Généticine
OVA+
Résistant
OVA
-
Sensible
OVA
R

Exemple de résultat obtenu par notre tutrice après vaccination intratumorale :
Fig.4 Suivi de la croissance tumorale après vaccination intra-tumorale
DISCUSSION
La croissance tumorale a baissé suite à l’injection de CpG-B et de manière encore plus
importante en présence de l’antigène tumoral OVAII. Cependant, il reste à déterminer si
ce sont bel et bien les pDC qui jouent un rôle dans la baisse de la croissance tumorale. Et
si ce sont bien elles, est-ce que c’est dû à leur rôle de cellule immunitaire innée, ou à leur
rôle dans le système immunitaire adaptatif en tant que cellules présentatrices d’
antigènes ?
RÉFÉRENCES
- Plasmacytoid Dendritic Cells: Recent Progress and Open Questions, Boris Reizis,
Anna Bunin, Hiyaa S. Gosh, Kanako L. Lewis and Vanja Sisirak
- The multifaceted biology of plasmacytoid dendritic cells, Melissa Swiecki and Marco
Colonna
REMERCIEMENTS
Un grand merci à Marion Humbert (notre tutrice), Pr. Stéphanie Hugues (directrice de
laboratoire), Carla Lippens, Juan Dubrot, Mathilde Lacroix, Anjalie Schlaeppi, Dale
Brighouse, qui nous ont accueilli dans le laboratoire, et à Cécile Gameiro (personnel de la
cytométrie en flux).
5
10
15
20
0
100
200
300
PBS
CpG-B
CpG-B+OVAII
Time (days)
Tumor
size
(mm2)
Vaccination
1
/
5
100%