1 - techniquiz


Je me
Je me
teste
teste
sur...
sur...
Sommaire général
SOMMAIRE GENERAL 7
Mode d’emploi 3
Sommaire 8
Enseignement obligatoire 11
Enseignement de spécialité 126
Lexique 154
Index 165
Guide d’installation du logiciel 167

Je me
Je me
teste
teste
sur...
sur...
Sommaire
8 SOMMAIRE
PARTIE I - ONDES ET MATIERE
1 Ondes et particules 11
2 Caractéristiques des ondes 20
3 Propriétés des ondes 27
4 Analyse spectrale 33
PARTIE II - LOIS ET MODELES
5 Temps, cinématique et dynamique newtoniennes 39
6 Mesure du temps et oscillateur, amortissement 50
7 Temps et relativité restreinte 58
8 Temps et évolution chimique : cinétique et catalyse 62
9 Structure et transformation de la matière : représentation
spatiale des molécules 66
10 Structure et transformation de la matière : transformation en
chimie organique 73
11 Réaction chimique par échange de proton 78
12 Energie, matière et rayonnement 85
../..

Je me
Je me
teste
teste
sur...
sur...
Sommaire
SOMMAIRE 9
Le sommaire suit les parties du programme officiel.
PARTIE III - DEFIS DU XXIE SIECLE
13 Economiser les ressources et respecter l’environnement 94
14 Synthétiser des molécules, fabriquer de nouveaux matériaux 101
15 Transmettre et stocker de l’information 108
16 Créer et innover 119
PARTIE IV - SPECIALITE
17 L’eau 126
18 Son et musique 135
19 Matériaux 143

1
Ondes et particules
PARTIE
I
-
ONDES
ET
MATIERE
11
Testez-vous sur ce chapitre avec l’option sujet/programme du logiciel.
De nombreux phénomènes naturels, la houle, le son ou la lumière, sont de
nature ondulatoire. En étudiant ces phénomènes, en particulier les
rayonnements issus du Cosmos, l’Homme a pu améliorer considérablement sa
connaissance de l’Univers. A partir de la simple observation de la lumière d’une étoile,
on peut en déduire son éloignement et sa composition chimique. La propagation d’une
onde s’accompagne toujours du déplacement de particules, mais pas toujours dans la
direction de l’onde.
A. Rayonnements dans l’Univers
1. Sources
L’Univers observable depuis la Terre comporte une grande variété d’objets : étoiles,
galaxies, nébuleuses, pulsars et quasars. Tous ces objets émettent des ondes
électromagnétiques visibles ou invisibles, que nous pouvons capter et analyser,
permettant ainsi d’en déterminer la composition ou la température.
a) Ondes électromagnétiques
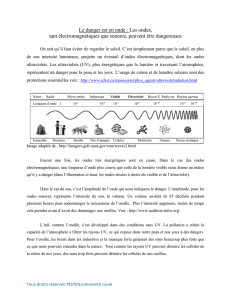
Pour caractériser une onde électromagnétique (OEM), on utilise soit la longueur
d’onde (λ), dans le vide, exprimée en mètres, soit la fréquence (f) exprimée en Hertz
(Hz). Ces deux grandeurs sont liées par la relation :
f
ν
λ
= λ : longueur d’onde (m)
ν
: célérité de l’onde (m.s
-1
)
f : fréquence (Hz)
Le
spectre
représente l’ensemble des ondes électromagnétiques. L’étendue des ondes
visibles ne représente qu’une très petite partie du spectre.
Spectre des ondes électromagnétiques :
λ : longueur d’onde (m)
GSM radar visible (400 nm violet - 750 nm rouge)
10
3
10
6
10
9
10
12
10
15
10
18
10
21
1M 1k 1 1m 1μ 1n 1p
f: fréquence (Hz)
TBF
radio lumière
X
γcosmiques
radio
TV
μ-ondes
I.R. UV
 6
6
 7
7
 8
8
1
/
8
100%