PDF Export - Analytical Toxicology

Neurotoxicité
Analytical Toxicology - Neurotoxicité | 1
Beaucoup de substances altèrent l’activité normale du système nerveux. Parfois ces effets
sont immédiats et passagers, comme l’effet stimulateur d’une tasse de café ou un mal de
tête de la peinture fraîche dans votre bureau. D’autres effets peuvent être beaucoup plus
insidieux, comme les désordres de mouvement soufferts par des mineurs après des années
d’intoxication chronique par la manganèse. Beaucoup d’agents sont inoffoncifs ou même
thérapeutiques aux doses faibles mais deviennent neurotoxiques à des niveaux plus élevés.
Les oligo-métaux et la pyridoxine (vitamine B-6) se rangent dans cette catégorie des effets
dépendants de la dose. Puisque ces agents affirment la maxime, « la dose fait le poison, » il
devient nécessaire d’avoir une définition significative de l’empoisonnement de système
nerveux, ou la neurotoxicité.
La Neurotoxicité se rapporte à la capacité d’un agent de compromettre l’intégrité
structurale ou fonctionnelle du système nerveux. Les dommages structurels des composants
de système nerveux ont habituellement comme conséquence une atteinte fonctionnelle,
bien que l’inverse ne soit pas toujours vrai.
Les changements de la fonction du système nerveuse peuvent se produire par des
interactions de toxiques avec les mécanismes normaux de signalisation de la
neurotransmission, ayant pour résultat des dommages structurels. Néanmoins, il est plus
facile d’identifier ces altérations, qu’elles soient structurales ou fonctionnelles, pour ensuite
définir l’adversité d’un tel agent vis-à-vis du système nerveux.
Sommaire
1 Rappel anatomophysiologique
2 La neurotoxicité
3 Sensibilité et facteurs de protection du système nerveux
4 Classification des substances neurotoxiques selon l’origine et l’impact sanitaire :
5 Principaux effets neurotoxiques
6 Clinique des intoxications du système nerveux :
7 Procédures d’évaluation

Neurotoxicité
Analytical Toxicology - Neurotoxicité | 2
Rappel anatomophysiologique
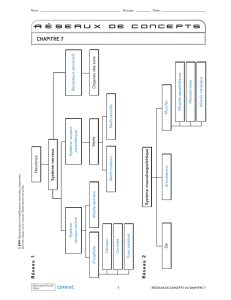
Le système nerveux est un système fort complexe qui tient sous sa dépendance toutes les
fonctions de l’organisme. Il se compose de centres nerveux, qui sont chargés de recevoir,
d’intégrer et d’émettre des informations, et de voies nerveuses qui sont chargées de
conduire ces informations.
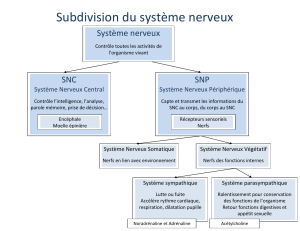
Au point de vue anatomique, on divise le système nerveux en trois parties.
Le système nerveux central est profondément situé dans des cavités osseuses (boîte
crânienne et canal vertébral) et entouré de membranes appelées méninges. Cette
partie, encore appelée névraxe, comprend deux segments:
– l’encéphale, qui est intracrânien
– la moelle épinière, qui est intrarachidienne.
Le système nerveux périphérique, représenté par les nerfs qui se détachent du
névraxe. Ces nerfs sont groupés en nerfs crâniens et nerfs rachidiens.
Le système nerveux sympathique ou autonome ou neurovégétatif. Il se subdivise
lui-même en orthosympathique et en parasympathique.
Le système nerveux central
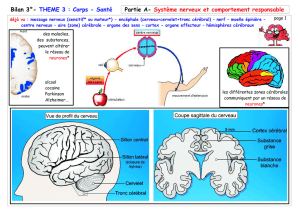
Le système nerveux centrale est constitué de deux parties principales : l’encéphale et la
moelle épinière. L’encéphale est lui même composé de : cerveau, cervelet et tronc cérébral.
A. L’encéphale :
a) Cerveau :
Le cerveau est la partie la plus volumineuse de l’encéphale. Il est également la partie la plus
noble du système nerveux central car il est le siège des facultés intellectuelles et des
activités conscientes. Envisagé dans son ensemble, il a une forme ovoïde à extrémité
postérieure renflée. Le cerveau comprend, d’une part, le télencéphale; d’autre part, le
diencéphale.
Organisation fonctionnelle
Ø Le télencéphale
A la structure du télencéphale sont liées les fonctions les plus importantes: conscience,

Neurotoxicité
Analytical Toxicology - Neurotoxicité | 3
intelligence, idéation, mémoire et volonté.
Le cortex du télencéphale est organisé en zone d’activité spécialisée.
Ø Le diencéphale
Les parois latérales sont formées des deux côtés par le thalamus.
Le thalamus est le principal centre d’intégration sous corticale de la sensibilité générale:
tact, sensations profondes, douleur et température, ainsi que des fonctions visuelle et
olfactive. Le thalamus décode une grande partie des informations qu’il reçoit. C’est aussi un
centre important de la motricité, dont il influence notamment la tonalité affective, qui
s’exprime par les gestes et la mimique.
La région hypothalamique renferme la substance grise centrale, qui contient les centres
supérieurs du système nerveux autonome pour l’équilibre hydrique, la thermorégulation, la
circulation, l’ingestion d’aliments, le métabolisme et l’état de sommeil ou de veille. Le
centre qui commande le rythme d’éveil et de sommeil s’y trouve également et est influencé
par le thalamus et par la formation réticulaire.
Lobes du cerveau
b) Le cervelet :
Il est situé en arrière du bulbe et de la protubérance annulaire, sous les lobes occipitaux du
cerveau. Il est séparé du cerveau par la scissure transverse et par une large toile méningée
disposée presque horizontalement au-dessus de la fosse postérieure du crâne, la tente du
cervelet.
Le cervelet est constitué de deux hémisphères réunis par une éminence longitudinale
appelée vermis. Les hémisphères sont constitués de lobes séparés par des scissures très
nettes.
Fonction
C’est un organe autonome de contrôle. En tant que centre moteur de l’encéphale, il exerce

Neurotoxicité
Analytical Toxicology - Neurotoxicité | 4
une action dans la coordination des mouvements et dans l’équilibration.
Le cervelet assure la coordination en retardant de quelques fractions de secondes l’envoi
des influx.
Le cervelet transmet aussi des influx qui interviennent dans la régulation du tonus postural,
c’est-à-dire dans l’entretien d’un degré de contraction musculaire qui assure le maintien
d’une posture. Il joue enfin un rôle dans l’équilibration, à partir des informations qu’il reçoit
de l’oreille interne.
c) Tronc cérébral :
Le tronc cérébral est la portion du névraxe comprise entre la moelle épinière et le cerveau.
Il est constitué de trois étages qui sont, de haut en bas, le mésencéphale, la protubérance
annulaire ou pont de Varole et le bulbe rachidien ou moelle allongée (myélencéphale).
Chacune de ces trois parties est en connexion avec le cervelet par deux pédoncules
cérébelleux, qui sont pairs et symétriques. Le tronc présente également les pédoncules
cérébraux, cordons blancs et courts, à trajet légèrement divergent.
Le tronc cérébral contient les noyaux d’origine des nerfs crâniens et d’importants centres
végétatifs.
Tronc cérébral
B. La moelle épinière :
La moelle épinière est la portion du système nerveux central qui occupe le canal rachidien.
Elle a la forme d’une longue tige cylindrique d’un diamètre d’environ un centimètre.
Elle présente deux renflements, l’un à la région cervicale, l’autre à la région dorsolombaire.
Ces deux renflements répondent à l’origine des plexus brachial et lombaire.
En dessous du renflement lombaire, la moelle épinière diminue très rapidement et elle se

Neurotoxicité
Analytical Toxicology - Neurotoxicité | 5
termine par une extrémité effilée appelée cône terminal, dont le sommet se continue par un
cordon filiforme, le filum terminale.
La moelle épinière mesure environ quarante cinq centimètres de long. Sa limite supérieure
est placée conventionnellement à hauteur de l’articulation occipito-atloïdienne. Chez
l’adulte, le cône terminal se situe à la hauteur de la deuxième vertèbre lombaire. La moelle
épinière épouse les courbures de la colonne vertébrale.
La moelle épinière
C. Les méninges et liquide céphalorachidien :
a) Les méninges
Les méninges constituent une triple enveloppe qui sépare le système nerveux central des
parois osseuses, des cavités dans lequel il se trouve (boîte crânienne et canal rachidien). Les
trois tuniques qui les composent sont, de dehors en dedans:
Ø la dure-mère, plaquée contre les parois osseuses et qui contient dans ses dédoublements
des sinus veineux.
Ø la pie-mère, qui tapisse étroitement le système nerveux.
Ø l’arachnoïde, entre les deux précédentes. Elle se compose de deux feuillets:
* le feuillet pariétal, adhérant à la dure-mère,
* le feuillet viscéral, en contact avec la pie-mère.
b) Liquide céphalo-rachidien
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
1
/
40
100%