Maladies métaboliques

MISE AU POINT
La Lettre du Neurologue - vol. IX - n° 8 - octobre 2005
276
L
es maladies métaboliques héréditaires sont des maladies
génétiques particulières dues à des mutations dans des
gènes codant, le plus souvent, pour des enzymes ou, par-
fois, d’autres protéines du métabolisme cellulaire. Le déficit
enzymatique est pathogène soit à cause de l’accumulation d’un
substrat toxique en amont du bloc métabolique, soit à cause du
défaut de synthèse d’un composé indispensable en aval. Contrai-
rement aux maladies génétiques diagnostiquées directement par
l’analyse moléculaire d’un gène, les maladies métaboliques héré-
ditaires sont diagnostiquées par des tests biochimiques spéci-
fiques qui cherchent à mettre en évidence l’accumulation ou le
défaut de synthèse d’un composé biochimique, ou bien à mesurer
l’activité d’une enzyme donnée. Ces maladies sont souvent acces-
sibles à des traitements tels qu’un régime spécial ou un médi-
cament visant à stimuler la voie métabolique perturbée ou une
voie parallèle, à remplacer un composé biochimique déficient, à
inhiber la synthèse d’un composé toxique ou encore à remplacer
l’enzyme elle-même (enzymothérapie). La prise en charge des
patients atteints de maladies métaboliques était traditionnel-
lement assurée par les pédiatres. Toutefois, cette situation risque
de changer. En effet, il est désormais acquis que la plupart des
maladies métaboliques peuvent débuter à l’âge adulte. De plus,
les progrès des traitements ont permis aux patients diagnostiqués
dans l’enfance de dépasser l’adolescence. Enfin, de nombreux
patients adultes, dont les premiers signes cliniques ont débuté
* Hôpital de la Pitié-Salpêtrière, Paris : fédération des maladies du système ner-
veux ; centre de référence des maladies lysosomales à expression neurologique ;
consultation pluridisciplinaire pour le diagnostic des maladies neurométa-
boliques (avec les Drs N. Baumann [neurochimiste] et A. Dürr [généticienne],
les Prs C. Lubetzki [neurologue], P. Aubourg [pédiatre] et J.M. Saudubray
[pédiatre métabolicien]).
Maladies métaboliques :
quand y penser, comment raisonner ?
Metabolic diseases: when to think of them, how to reason?
●F. S edel*
Inborn metabolic diseases are rare diseases usually due to
mutations in genes coding for enzymes. Although first clinical
signs often appear in childhood, mild clinical forms exist that
can begin during adolescence or adulthood. The clinical pre-
sentation can be an acute encephalopathy which must be
diagnosed and treated quickly or a chronic progressive disorder
characterized by the heterogeneity of involved organs. The aim
of this review is to summarize main characteristics of adult forms
of inborn metabolic diseases with a neurological expression. We
also propose diagnostic orientations according to the radio-
logical, electrophysiological and ophthalmologic signs.
Keywords: Inborn errors of metabolism – Coma – Adult onset –
Leukodystrophy.
SUMMARY
SUMMARY
■Les maladies métaboliques héréditaires sont dues à des
mutations de gènes codant pour des enzymes.
■Les modes de présentation sont variables, allant d’affec-
tions neurologiques chroniques peu évolutives à l’encéphalo-
pathie aiguë, rapidement mortelle en l’absence de traitement
adéquat.
■De nombreuses maladies métaboliques sont accessibles
à des traitements spécifiques, d’où l’importance d’en faire
le diagnostic.
■Devant tout coma inexpliqué, il convient de réaliser un
bilan biologique à la recherche d’un trouble du métabolisme
intermédiaire, avec, en particulier, dosage de l’ammoniémie
et de l’homocystéinémie.
■Devant une présentation neurologique complexe, la
démarche diagnostique doit être guidée par un bilan de
“débrouillage” incluant examen clinique neurologique
et général, IRM cérébrale, électromyogramme et examen
ophtalmologique. Les causes traitables doivent être recher-
chées en priorité.
■L’approche diagnostique doit être pluridisciplinaire et
s’appuyer sur un réseau de spécialistes.
Mots-clés : Maladies métaboliques héréditaires – Coma –
Adulte – Leucodystrophie.
POINTS FORTS
POINTS FORTS

La Lettre du Neurologue - vol. IX - n° 8 - octobre 2005 277
dans l’enfance, n’ont pas été diagnostiqués par les pédiatres, car
le diagnostic de leur affection n’était pas possible à l’époque. Le
fait que ces pathologies touchent, dans la très grande majorité
des cas, le système nerveux explique que les neurologues sont
souvent les premiers à évoquer la possibilité d’une maladie
métabolique. Cette mise au point a pour but de donner un aperçu
général des maladies métaboliques dont les signes neurologiques
peuvent apparaître à l’âge adulte.
ÉPIDÉMIOLOGIE (1)
Il a été estimé que 30 % des maladies génétiques sont dues à des
mutations de gènes codant pour des enzymes du métabolisme (1).
Plus de 500 maladies métaboliques sont actuellement connues.
L’incidence des maladies métaboliques est évaluée à environ
1/2 500 nouveau-nés vivants. Ces maladies débutent dans 20 %
des cas à l’adolescence, voire à l’âge adulte (2). Toutefois, ce
chiffre est probablement très sous-estimé car, du fait de l’absence
d’enseignement spécifique, les maladies métaboliques sont mal
connues et donc rarement recherchées par les médecins en charge
d’adultes. Une illustration en est donnée par le déficit en porpho-
bilinogène désaminase (porphyrie aiguë intermittente), présent
chez un sujet sur 500 dans les études de dépistage systéma-
tique, mais diagnostiqué chez un sujet sur 100 000 seulement,
une différence qui ne s’explique pas uniquement par la péné-
trance faible de la maladie (estimée à 10 %). De même, alors que
l’incidence du déficit en ornithine transcarbamylase est évaluée
à 1/12 000 naissances, une dizaine de cas seulement sont dia-
gnostiqués chaque année en France !
QUAND SUSPECTER UNE MALADIE MÉTABOLIQUE ?
Il est difficile d’établir un tableau clinique commun aux maladies
métaboliques tant celles-ci diffèrent les unes des autres. Les circons-
tances de leur découverte peuvent être un aspect de leucodystrophie
en IRM, un tableau neurologique paraissant inhabituel ou une
encéphalopathie aiguë. Les signes neurologiques d’appel sont peu
spécifiques et peuvent être isolés au début : mouvements anormaux,
aspect de leucoencéphalopathie en IRM, troubles psychiatriques,
ataxie cérébelleuse, polyneuropathie, paraparésie spastique, troubles
visuels, épilepsie. Les épisodes d’encéphalopathie associent sou-
vent des troubles de la vigilance, des signes généraux (signes
digestifs, céphalées, hyperpnée en cas d’acidose métabolique),
parfois des crises convulsives, voire des signes neurologiques
focaux tels qu’une parésie oculomotrice, un déficit uni- ou bila-
téral, et apparaissent volontiers dans un contexte fébrile (dans ce
cas, le diagnostic d’encéphalite est souvent porté à tort). D’une
façon générale, plusieurs éléments de l’anamnèse et de l’examen
clinique doivent faire suspecter une maladie métabolique :
•Une affection neurologique pour laquelle les étiologies habi-
tuelles (vasculaires, infectieuses, dysimmunitaires, inflammatoires,
tumorales, dégénératives classiques, métaboliques acquises,
toxiques, etc.) ont été recherchées et éliminées.
•Le caractère hétéroclite, parfois multisystémique, du tableau
clinique est un bon élément d’orientation. Par exemple, il est fré-
quent d’observer chez un même patient une atteinte du système
nerveux central, une atteinte oculaire, une atteinte du système
nerveux périphérique, une organomégalie, des signes cutanés tels
que des angiokératomes.
•Le mode de transmission est habituellement autosomique récessif,
parfois lié à l’X, mais exceptionnellement autosomique dominant.
•Ces maladies peuvent évoluer de façon chronique mais parfois
–et dans ce cas il s’agit d’un élément très évocateur –, il existe des
épisodes aigus isolés ou apparaissant sur un fond de détérioration
neurologique chronique. Ces épisodes aigus sont d’autant plus évo-
cateurs qu’ils sont déclenchés dans des situations de sollicitation
métabolique accrue (grossesses, infections, efforts inhabituels,
jeûne, repas riches en protéines, interventions chirurgicales, etc.).
•Enfin, même si les premiers symptômes peuvent apparaître à
l’âge adulte, il est habituel de retrouver des signes, même discrets,
dans l’enfance.
COMMENT RAISONNER DEVANT UNE SUSPICION
DE MALADIE MÉTABOLIQUE ?
Étant donné le nombre très important de maladies métaboliques,
il serait illusoire d’envisager un bilan systématique. On peut pro-
poser toutefois quelques schémas généraux.
L’existence d’épisodes aigus nécessite de réaliser des examens à la
recherche d’un trouble du métabolisme intermédiaire [métabolisme
des sucres, des acides gras, des acides aminés, voies de production
d’ATP, métabolisme des neurotransmetteurs, porphyries], (encadré).
Nous insistons sur la nécessité de doser l’ammoniémie devant une
encéphalopathie aiguë inexpliquée. Cet examen simple permet de
dépister les troubles du cycle de l’urée et, en particulier, le déficit
en ornithine transcarbamylase qui peut se révéler à l’âge adulte (dans
les deux sexes) par une encéphalopathie évoluant vers un coma avec
œdème cérébral diffus et aboutissant au décès si un traitement adé-
quat n’est pas mis en œuvre rapidement. De même, il faut connaître
les troubles de la reméthylation de l’homocystéine, qui peuvent se
présenter par des encéphalopathies aiguës ou subaiguës à répétition
souvent associées à des troubles psychiatriques, et dont les séquelles
neurologiques peuvent être catastrophiques en l’absence de trai-
tement.
(suite de texte p. 281)
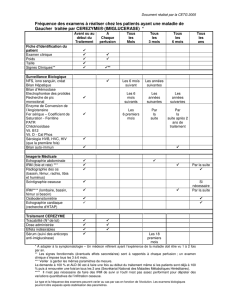
Maladies Examens biologiques de dépistage
Troubles du cycle de l’urée Ammoniémie
Troubles de la reméthylation de l’homocystéine Homocystéinémie, CAA
Déficit en pyruvate déshydrogénase Lactates/pyruvate sanguins ± LCR
Aciduries organiques CAO
Hyperglycinémie sans cétose CAA
Porphyries aiguës Aminolévulinate, porphobilinogène urinaires
Maladie de Wilson Cuprémie/céruléoplasminémie
Déficit en medium-chain acyl-CoA dehydrogenase Profil des acylcarnitines
Cytopathies mitochondriales Lactates/pyruvate sanguins ± LCR
CAA : chromatographie des acides aminés (sang et urines) ; CAO : chromatographie des acides organiques (urine).
Encadré. Causes métaboliques d’encéphalopathies aiguës chez l’adulte.

MISE AU POINT
La Lettre du Neurologue - vol. IX - n° 8 - octobre 2005
278
Troubles du métabolisme Principaux signes cliniques et radiologiques Principale(s) anomalie(s) biologique(s) Traitement Test de dépistage
intermédiaire
Déficit en ornithine Épisodes d’encéphalopathie (syndrome confusionnel, Hyperammoniémie. Régime pauvre en protéines, Ammoniémie.
transcarbamylase (lié à l’X) troubles psychiatriques, troubles digestifs, céphalées, coma). CAA : hyperglutaminémie, hypocitrullinémie. phénylbutyrate, benzoate
IRM : normale ou hypersignal cortical étendu CAO : augmentation de l’acide orotique urinaire. de sodium, arginine.
(insulaire et frontal). TDM : normale ou œdème cérébral
au cours des décompensations.
Phénylcétonurie Paraparésie spastique, démence, troubles visuels, Hyperphénylalaninémie, hypotyrosinémie. Régime pauvre en phénylalanine. Test de Guthrie
leucoencéphalopathie. (dépistage néonatal)
ou CAA.
Homocystinurie par déficit Retard mental, psychose, épilepsie, accidents Homocystéine > 100 M, hyperméthioninémie, Pyridoxine (vitamine B6) Homocystéine
en cystathionine bêta-synthase thromboemboliques, dystonie focale ou généralisée, activité cystathionine bêta-synthase effondrée.±folates, bétaïne, vitamine B12. plasmatique totale.
syndrome marphanoïde, luxation des cristallins.
Homocystinurie par déficit Épisodes psychotiques récidivants, para- ou tétraparésie Hyperhomocystéinémie, hypométhioninémie Vitamine B12 per os, folates, Homocystéine.
en méthylène tétrahydrofolate spastique, épisodes d'encéphalopathie, accidents ischémiques ± acidurie méthylmalonique ± folates diminués. bétaïne.
réductase ou trouble cérébraux, rétinite pigmentaire (inconstante),
du métabolisme de la cobalamine polyneuropathie. IRM : leucoencéphalopathie (inconstante).
Hyperglycinémie sans cétose Ataxie cérébelleuse, paraparésie spastique, mouvements Hyperglycinémie, hyperglycinurie, rapport glycine Benzoate de sodium, CAA.
choréiques, atrophie optique, épilepsie, atteinte de la corne LCR/sang > 0,08. Diminution de l’activité dextro-méthorphane.
antérieure. Évolution chronique ou par crises déclenchées du complexe de clivage de la glycine (sang).
par des épisodes fébriles.
IRM : agénésie du corps calleux (inconstante).
Déficit en ornithine Rétrécissement concentrique du champ visuel (atrophie Hyperornithinémie : 5 à 20 fois la normale, Vitamine B6: 300 à 600 mg/j CAA.
aminotransférase chorio-rétinienne progressive) ± faiblesse musculaire, activité ornithine amino-transférase effondrée. ± régime pauvre en arginine.
polyneuropathie, retard mental, troubles psychiatriques.
Acidurie glutarique de type I Céphalées, paralysie supranucléaire, crises d’épilepsie, Pic urinaire d’acide glutarique et d’acide Carnitine (Lévocarnyl®). CAO.
troubles cognitifs, leucoencéphalopathie. 3-hydroxyglutarique. Diminution de l’activité
Décompensation lors d’épisodes fébriles. glutaryl-CoA déshydrogénase.
Acidurie propionique Chorée, démence, retard mental, Pic urinaire d’acide propionique, de glycine, Régime pauvre en acides aminés CAO.
antécédents de vomissements/léthargie dans l'enfance. de 3-hydroxy-propionate et de propionylglycine. ramifiés (leucine, isoleucine, valine).
Acidurie 2-hydroxyglutarique Retard psychomoteur, syndrome frontal, syndrome Pic urinaire d’acide 2- hydroxyglutarique. Carnitine (Lévocarnyl®). CAO.
parkinsonien, syndrome cérébelleux. IRM :
leucoencéphalopathie à la jonction cortex-substance blanche.
Cytopathies mitochondriales Syndrome myogène, neuropathie sensitive, épilepsie, Signes d’orientation :élévation des lactates dans Pas de traitement efficace Lactates, pyruvate dans
syndrome cérébelleux, syndrome parkinsonien, dystonie, le sang et le LCR, avec rapport lactate/pyruvate > 20 ; démontré. On peut proposer sang et le LCR ± biopsie
céphalées, pseudo-AVC, syndrome pyramidal, cataracte, CAA : augmentation de l’alanine ; CAO : présence carnitine (Lévocarnyl®), musculaire si tableau
rétinite pigmentaire, troubles oculomoteurs, ptosis, vertiges, d’intermédiaires du cycle de Krebs ; coenzyme Q10 (ubiquinone), clinique évocateur
hypoacousie, diabète, troubles endocriniens. biopsie musculaire : fibres rouges déchiquetées, riboflavine. ou si lactates élevés.
Signes IRM possibles : nécrose ou calcifications des noyaux fibres COX négatives, diminution de l’activité
lenticulaires, hypersignal des faisceaux pyramidaux, des complexes de la chaîne respiratoire,
des noyaux rouges, de la substance blanche cérébelleuse, mutations de l’ADN mitochondrial ou nucléaire.
des noyaux dentelés, de la substance blanche sus-tentorielle.
Déficit en coenzyme Q10 – Forme musculaire : triade myoglobinurie récurrente, Diminution du coenzyme Q10 Coenzyme Q10. Dosage coenzyme Q10.
intolérance à l'exercice, atteinte du CNS. (dosage sur biopsie musculaire).
– Forme ataxique : ataxie cérébelleuse, polyneuropathie,
crises d'épilepsie, signes pyramidaux, retard mental.
Déficit en pyruvate déshydrogénase Ataxie épisodique, retard mental, crises d’épilepsie, Élévation des lactates et du pyruvate dans le sang Régime cétogène, dichloroacétate, Dosage lactates, pyruvate
(lié à l’X le plus souvent) polyneuropathie, atrophie optique, chorée, (postprandial) et le LCR, avec rapport vitamine B1 à jeun et en postprandial.
syndrome parkinsonien. IRM : nécrose des noyaux gris lactates/pyruvate < 20. Baisse de l’activité PDH
centraux, parfois normale. (leucocytes).
Déficit en long-chain Hypoglycémies, rhabdomyolyses à l'effort, rétinite Augmentation des acylcarnitines à longues chaînes. Éviter le jeûne prolongé. Profil des acylcarnitines
hydroxyacyl-CoA déhydrogenase pigmentaire, polyneuropathie. plasmatiques.
(LCHAD)
Déficit en medium-chain acyl-CoA Rhabdomyolyse aiguë lors du jeûne prolongé Augmentation des acylcarnitines à chaînes moyennes. Perfusion de soluté glucosé. Profil des acylcarnitines
dehydrogenase ou d’efforts inhabituels ; encéphalopathie aiguë, plasmatiques.
troubles du rythme cardiaque. .../...
Tableau I. Principales maladies métaboliques dont les signes neurologiques peuvent apparaître à l’âge adulte.

La Lettre du Neurologue - vol. IX - n° 8 - octobre 2005 279
.../...
Troubles du métabolisme Retard mental, troubles du comportement, crises d'épilepsie, Spectro-RMN cérébrale : baisse du pic de créatine. Supplémentation en créatine. Spectro-RMN cérébrale.
de la créatine (parfois liés à l’X) mouvements anormaux.
Déficit en GTP cyclohydrolase 1 Dystonie prédominant aux membres inférieurs, Diminution des bioptérines et de la néoptérine, L-dopa ou anticholinergiques Test à la L-dopa.
(autosomique dominant) syndrome parkinsonien, aggravation diurne des symptômes, dans le LCR, mutations du gène de la cyclohydrolase 1. ou agonistes dopaminergiques.
réponse complète à la L-dopa.
Déficit en pyruvoyl- Dystonie généralisée avec fluctuations diurnes, Hyperprolactinémie. BH4, L-dopa, lévotonine, Prolactinémie,
tetrahydrobioptérine synthase dystonie paroxystique, retard mental, syndrome pyramidal, Hyperphénylalaninémie. LCR : bioptérine basse ; régime pauvre en phénylalanine. phénylalanine,
(PTPS) crises d’épilepsie, myoclonies, hypersalivation. augmentation des néoptérines. test à la L-dopa.
Syndrome de Lesch-Nyhan Mouvements choréoathétosiques, automutilations, Hyperuricémie, dosage enzymatique (HGPRT). Allopurinol. Uricémie.
(lié à l’X) retard mental (inconstant).
Porphyries aiguës Attaques : douleurs abdominales, constipation, vomissements, Hyperexcrétion d’acide -aminolévulinique + Perfusions d’hème (Normosang®) ; Dosage urinaire
neuropathie sensitivomotrice aiguë, syndrome confusionnel, porphobilinogène urinaire éviter les facteurs favorisant de l’acide
troubles psychiatriques, convulsions, dysautonomie, (sauf déficit en aminolévulinate déshydratase). les crises (médicaments, alcool). -aminolévulinique
hyponatrémie, urines rouges/noires à la lumière. et du porphobilinogène.
Signes cutanés (si coproporphyrie héréditaire ou porphyrie
variegata).
IRM : leucoencéphalopathie postérieure (inconstante).
Troubles du métabolisme Principaux signes cliniques et radiologiques Anomalies biologiques Traitement Test de dépistage
des molécules complexes
Maladies lysosomales
Leucodystrophie métachromatique Troubles psychiatriques, troubles cognitifs, paraparésie, Activité arylsulfatase A effondrée, sulfatidurie positive. Discuter l’allogreffe Dosage
ataxie cérébelleuse, crises d’épilepsie, polyneuropathie de moelle osseuse. de l’arylsulfatase A
démyélinisante. (sang).
IRM : leucoencéphalopathie diffuse périventriculaire.
Maladie de Krabbe Paraparésie spastique, ataxie, syndrome bulbaire, troubles Déficit en galactocérébrosidase. Discuter l’allogreffe de moelle Dosage
vésicosphinctériens, neuropathie périphérique, pieds creux. osseuse. de la galacto-
IRM : leucoencéphalopathie postérieure touchant cérébrosidase (sang).
les faisceaux pyramidaux.
Maladie de Fabry Douleurs/paresthésies des extrémités survenant par crises. Déficit en -galactosidase. Enzymothérapie Dosage de l’-galacto-
(liée à l’X) AVC, polyneuropathie, hypohydrose, cornée verticillée, (Fabrazyme®, Réplagal®). sidase (sang).
cataracte, insuffisance rénale, cardiomyopathie,
angiokératomes, surdité.
Maladie de Niemann-Pick Troubles psychiatriques, troubles cognitifs, dystonie, Test à la filipine (sur fibroblastes) : Miglustat (Zavesca®) ? Test à la filipine
de type C syndrome parkinsonien, syndrome cérébelleux, paralysie accumulation anormale de cholestérol libre. sur fibroblastes.
oculomotrice supranucléaire verticale, splénomégalie.
IRM : atrophie.
Gangliosidose à GM1 Dystonie généralisée, syndrome parkinsonien, dysarthrie, Activité effondrée de la ß-galactosidase. Miglustat (Zavesca®) ? Dosage
retard mental modéré, cyphoscoliose, tassements vertébraux. de la ß-galactosidase
IRM : hypersignal des putamens. (sang).
Gangliosidose à GM2 Syndrome cérébelleux, atteinte du motoneurone, dystonie, Déficit en hexosaminidase A (maladie de Tay-Sachs) Miglustat (Zavesca®) ? Dosage
syndrome pyramidal, démence, troubles psychiatriques, ou A+B (maladie de Sandhoff). des hexosaminidases
paralysie oculomotrice supranucléaire, dysautonomie, (sang).
polyneuropathie. IRM : atrophie cérébelleuse et corticale.
Maladie de Gaucher de type I Syndrome parkinsonien peu DOPA-sensible, syndrome Déficit en ß-glucosidase. Enzymothérapie (Cerezyme®), Dosage
du canal carpien, compression médullaire, tremblement Miglustat (Zavesca®). de la ß-glucosidase
d’attitude, splénomégalie, cytopénies, douleurs osseuses, (sang).
fractures pathologiques, hypertension artérielle pulmonaire.
Maladie de Gaucher de type III Épilepsie myoclonique, ataxie cérebelleuse, Déficit en ß-glucosidase. Enzymothérapie (Cerezyme®), Dosage
démence, paralysie supranucléaire horizontale, Miglustat (Zavesca®). de la ß-glucosidase
hépatosplénomégalie, troubles hématologiques et osseux. (sang).
Maladie de Sanfilippo Troubles du comportement, démence, Excrétion urinaire d’héparane sulfate, Aucun. Dosage
(mucopolysacchari-dose retard mental (inconstant), dysmorphie, surdité. mesures des activités enzymatiques. des mucopolysaccharides
de type III) urinaires.
Déficit en -mannosidase Retard mental (inconstant), ataxie cérébelleuse, surdité, Excrétion urinaire anormale d’oligosaccharides, Discuter l’allogreffe de moelle Recherche
syndrome pyramidal, ± (peuvent manquer) infections ORL déficit en -mannosidase. osseuse. d’oligosaccharides
à répétition, splénomégalie, dysmorphie, urinaires.
anomalies squelettiques. .../...

MISE AU POINT
La Lettre du Neurologue - vol. IX - n° 8 - octobre 2005
280
.../...
Déficit en ß-mannosidase Retard mental, troubles du comportement, tics, surdité, Excrétion urinaire anormale d’oligosaccharides, Non connu. Recherche
angiokératomes, infections ORL à répétition, déficit en ß-mannosidase. d’oligosaccharides
polyneuropathie démyélinisante. urinaires.
Sialidose Myoclonies, épilepsie, ataxie, macula rouge cerise. Excrétion urinaire anormale d’oligosaccharides Aucun. Recherche
(déficit en neuraminidase) sialylés, déficit en neuraminidase. d’oligosaccharides
urinaires.
Céroïde-lipofuscinose Démence, syndrome extrapyramidal, épilepsie, Dépôts de lipofuscine (aggrégats lipido-protéiques) Aucun. Biopsies de peau
(maladie de Kufs) syndrome cérébelleux. IRM : atrophie cérébrale diffuse. en forme d’empreintes digitales en microscopie et de rectum.
(parfois autosomique dominant) électronique.
Maladies péroxysomales
Adrénoleuco-dystrophie Adrénomyéloneuropathie (hommes) : paraparésie spastique, Augmentation des acides gras à très longue chaîne,Discuter un régime à base d’huile Dosage des acides gras
(liée à l’X) troubles sensitifs, polyneuropathie, insuffisance surrénale. mutations du gène de l’ALDP. de Lorenzo. à très longues chaînes.
IRM : normale ou hypersignaux touchant les faisceaux
pyramidaux et/ou la SB postérieure.
Adrénoleucodystrophie cérébrale (hommes) : troubles
psychiatriques, troubles visuels, déficit moteur, démence,
surdité.
Femmes hétérozygotes, dans 20 % des cas, paraparésie
spastique, troubles sphinctériens, troubles sensitifs
de début tardif. IRM le plus souvent normale.
Maladie de Refsum Rétinite pigmentaire, polyneuropathie, ataxie cérébelleuse, Augmentation de l’acide phytanique, acidité effondrée Régime pauvre en acide Dosage de l’acide
surdité, anosmie, ichtyose, hyperprotéinorachie. de la phytanoyl-CoA hydroxylase. phytanique, LDL aphérèses. phytanique.
Déficit en -méthylacyl- Rétinite pigmentaire, polyneuropathie, crises d'épilepsie, Augmentation acide pristanique et acides biliaires Régime pauvre en acide Dosage de l’acide
CoA racémase (AMACR) paraparésie spastique, atrophie optique, épisodes (DHCA et THCA). phytanique. pristanique.
d’encéphalopathie aiguë. IRM : normale ou hypersignal
thalamique, protubérantiel et des pédoncules cérébelleux.
Métabolisme du glycogène
Maladie à dépôts Atteinte progressive des premiers et seconds motoneurones, Biopsie de creux axillaire : mise en évidence Aucun. Biopsie de creux axillaire.
de polyglucosans troubles sensitifs, polyneuropathie, troubles vésicaux, de polyglucosans. Parfois, mutations de l’enzyme
démence, syndrome parkinsonien. branchante du glycogène.
IRM : leucoencéphalopathie diffuse, atrophie cérébrale,
cérébelleuse et du tronc cérébral.
Métabolisme du cuivre
Maladie de Wilson Syndrome parkinsonien, tremblement d’action, dystonie, Céruléoplasmine plasmatique et cuprémie basses, Zinc, D-pénicillamine, trientine. Dosage cuprurie,
troubles psychiatriques, dépôts cornéens, atteinte hépatique, cuprurie des 24 heures augmentée. cuprémie,
crises hémolytiques. IRM (T2) : hypersignal putamen, céruléo-plasmine.
thalami, protubérance, noyaux dentelés.
Métabolisme du fer
Hypocéruléoplasminémie Syndrome parkinsonien, mouvements choréiques, Céruléoplasmine plasmatique et cuprémie basses, Déféroxamine (Desféral®). Céruléo-plasmine.
dégénérescence rétinienne, démence, ataxie cérebelleuse, ferritinémie élevée, fer sérique bas,
diabète. IRM : hyposignaux des noyaux gris centraux. anémie microcytaire.
Troubles du métabolisme
des acides biliaires
Xanthomatose cérébrotendineuse Retard mental, syndrome pyramidal, ataxie cérébelleuse, Élévation du cholestanol plasmatique Acide chénodésoxy-cholique, Dosage du cholestanol.
démence, polyneuropathie, épilepsie, cataracte, xanthomes et des alcools biliaires. statines.
tendineux, diarrhée chronique.
IRM : hypersignaux des noyaux dentelés, de la substance
blanche périventriculaire, des pallidums.
Troubles du métabolisme
du cholestérol
Maladie de Tangier Mononeuropathie multiple à rechute ou neuropathie Cholestérol-HDL effondré, élévation des triglycérides, Régime pauvre en cholestérol. Dosage HDL-cholestérol.
touchant les petites fibres (syndrome diminution de l’ApoA1.
pseudo-syringomyélique), diplégie faciale, amygdales
oranges, splénomégalie ± hépatomégalie, dépôts orangés
cutanés et cornéens, cataracte.
 6
6
 7
7
1
/
7
100%