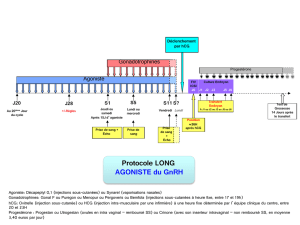
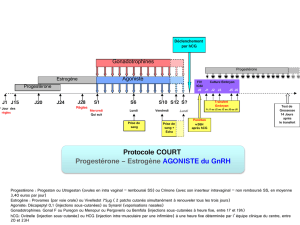
Hormone lutéinisante (LH) et gonadotrophine chorionique humaine

32 | La Lettre du Gynécologue • n° 350 - mars 2010
MISE AU POINT
Hormone lutéinisante (LH)
et gonadotrophine chorionique
humaine (hCG) :
vraies ou fausses jumelles ?
LH (Luteinizing Hormone) and hCG (human Chorionic
Gonadotropin): twins or not twins?
J. Smitz*
L
es dix dernières années ont été marquées
par une évolution des protocoles de stimu-
lation ovarienne pour fécondation in vitro
(FIV) vers des cycles de plus en plus éloignés de la
physiologie, fournissant matière à un réexamen des
connaissances sur les rôles respectifs de l’activité des
gonadotrophines dans la maturation du complexe
folliculo-ovocytaire (1, 2).
Le traitement par gonadotrophines a été couplé
à l’administration d’analogues de la GnRH (gona-
tropin-releasing hormone ou gonado-libérine) afin
de prévenir l’apparition des pics prématurés de LH
(Luteinizing Hormone ou hormone lutéinisante) et
réduire la production endogène de LH active. Mais
ces protocoles soulèvent la question du besoin
minimal en activité LH pour un soutien efficace de
la stéroïdogenèse (1).
Depuis 50 ans, des gonadotrophines d’origine humaine
(hMG) sont utilisées pour l’induction de l’ovulation.
De nos jours, l’arsenal thérapeutique s’est élargi et
différentes gonadotrophines sont disponibles et
sont soit d’origine humaine et issues de techniques
biochimiques de haute purification, soit d’origine
synthétique et issues de génie génétique. Ces gona-
dotrophines, du fait de leur différence de composi-
tion, notamment en termes d’activité LH, peuvent
présenter des divergences en termes d’activité.
De nombreux travaux de recherche au niveau cellu-
laire et de nouvelles méthodes d’analyse (dosages
immunométriques spécifiques, études d’interaction
avec le récepteur, ou puces à ADN ou protéines…)
ont permis de comparer finement la LH et l’hCG
(human Chorionic Gonadotropin ou gonadotrophine
chorionique humaine). En plus des actions connues
de l’hCG via le récepteur LH/hCG-R, l’hCG aurait
un champ d’action beaucoup plus large. Les événe-
ments clés (recrutement folliculaire, sélection d’un
follicule, atrésie des plus petits follicules) dépendent,
selon le moment de la phase folliculaire, de l’activité
prépondérante de l’une ou l’autre gonadotrophine
ainsi que du statut en récepteurs à la LH des cellules
de la granulosa (3).
LH et hCG : ressemblances
et différences structurales
Des structures moléculaires
très proches
L’activité LH peut avoir deux origines : la LH et
l’hCG, qui sont deux hormones très proches par
leur structure :
– ces deux glycoprotéines sont constituées de deux
sous-unités différentes, α et β, liées par des liaisons
non covalentes (4) ;
– la sous-unité α est commune aux deux hormones.
Il s’agit d’une glycoprotéine de 99 acides aminés
possédant 3 sites de glycosylation (4) ;
– la séquence des 121 premiers acides aminés des
sous-unités β de la LH et de l’hCG présente 96 %
d’homologie (5).
Les sous-unités β ne comportent pas le même nombre
d’acides aminés : 121 pour la LH, 145 pour l’hCG (4).
Ce sont ces 34 acides aminés supplémentaires du côté
C-terminal de la séquence protéique de la chaîne β de
l’hCG qui confèrent la signature biologique.
* Centre de médecine de la reproduc-
tion, Vrije Universiteit Brussel (VUB).

La Lettre du Gynécologue • n° 350 mars 2010 | 33
Résumé
La LH et l’hCG diffèrent aussi en nombre de sites
de glycosylation présents sur leur chaîne β (4) : 6
sites de glycosylation pour l’hCG, 1 seul pour la LH.
La nature des résidus sucrés varie au cours du cycle
et dépend du milieu hormonal ; par exemple, on a
identifié jusqu’à 7 isoformes de la LH (6).
Un récepteur membranaire commun
LH/hCG-R
Pour exercer leur rôle biologique, la LH et l’hCG se
fixent sur le même récepteur LH/hCG-R, un récep-
teur à 7 domaines transmembranaires couplés aux
protéines G (4). Selon Rao (7), l’utérus est l’un des
nombreux organes ou tissus possédant des récep-
teurs LH/hCG-R. La densité de ces récepteurs y est
moins élevée que dans l’ovaire, où ils sont présents
au niveau de la thèque et des cellules de la granulosa
des follicules antraux.
La fixation de la LH ou de l’hCG au récepteur entraîne
une cascade de réactions physiologiques qui influen-
cent directement des événements tels que l’initia-
tion de la grossesse, le maintien de la grossesse et le
déclenchement de l’accouchement (7). Mais la loca-
lisation ubiquitaire des récepteurs LH/hCG-R (utérus,
myomètre, ovaires, vaisseaux sanguins…) suggère la
possibilité d’un rôle beaucoup plus vaste de l’activité
LH. Des travaux sur l’endomètre ont ainsi révélé un effet
direct de l’activité LH sur différents facteurs impliqués
dans les processus de différenciation endométriale,
d’angiogenèse et de remodelage tissulaire (8).
D’autres travaux ont montré les effets bénéfiques
d’une administration d’hCG, mimant les effets du
pic préovulatoire de LH, sur l’épaisseur et la récep-
tivité endométriale chez des femmes en FIV, dont
la sécrétion endogène de LH avait été supprimée
par l’administration d’un agoniste de la GnRH (9).
Polymorphismes génétiques de la LH,
de l’hCG et du récepteur LH/hCG-R :
un impact sur la fertilité ?
Sept familles d’isoformes et de nombreuses sous-
familles ont été identifiées pour la LH. Tous n’inter-
agissent pas avec la même affinité avec le récepteur
LH/hCG-R, certains isoformes sont moins ou pas
du tout bioactifs (6). De même, il existe différents
isoformes de l’hCG qui diffèrent entre eux par le
taux de glycosylation. Des travaux ont montré qu’il
y aurait une corrélation entre le taux de grossesses
évolutives et le taux d’hCG hyperglycosylées en
début de grossesse (10). Certaines formes d’infertilité
pourraient être dues à des mutations du récepteur
LH/hCG-R (11).
Intérêts pharmaco-chimiques
de l’hCG
Une liaison de l’hCG pour le récepteur
LH/hCG-R beaucoup plus stable
Les membranes cellulaires des tissus cibles possè-
dent des motifs saccharidiques (les lectines) capables
d’interagir spécifiquement avec des protéines ou
des glycoprotéines (LH et hCG) pour former des
liaisons non covalentes et stabiliser la liaison entre
le récepteur et l’hormone. Cette stabilisation, direc-
tement due à une glycosylation plus importante
de l’hCG, n’est pas observée avec la LH (12). Ainsi,
la différence de glycosylation entre la LH et l’hCG
expliquerait que la liaison entre l’hCG et le récepteur
LH/hCG-R soit plus stable que celle entre la LH et
le récepteur (12).
Une durée d’action beaucoup plus
longue pour l’hCG
Des études ont comparé la production d’hormones
stéroïdiennes dans les cellules lutéales et dans les
cellules de Leydig après une stimulation continue
ou pulsatile d’hCG ou de LH (13, 14). Ces travaux
ont permis de montrer une production d’hormones
stéroïdiennes prolongée dans le temps après stimu-
lation par hCG, alors que la durée de la réponse est
limitée dans le temps en cas de stimulation pulsa-
tile ou continue par la LH. Cette différence dans la
durée d’action des deux hormones s’explique par une
affinité pour le récepteur environ 10 fois supérieure
pour l’hCG que pour la LH.
Dans les protocoles de stimulation ovarienne pour fécondation
in vitro
, le traitement par gonadotrophines
est couplé à l’administration d’analogues de la GnRH qui visent à prévenir un pic de LH, mais qui, en même
temps, diminuent significativement les taux de LH résiduels. Ces protocoles soulèvent donc la question du
besoin minimal en activité LH pour un soutien suffisant et efficace de la stéroïdogenèse. Différentes gonado-
trophines, issues soit de techniques biochimiques de haute purification, soit de génie génétique, apportent,
outre la FSH, de la LH et/ou de l’hCG.
LH et hCG sont des gonadotrophines proches ; elles ont des structures moléculaires voisines et partagent
le même récepteur transmembranaire : le récepteur LH/hCG-R. Malgré leur forte similitude structurale, LH
et hCG diffèrent en termes de bioactivité. Par rapport à la LH, la liaison de l’hCG au récepteur LH/hCG-R est
beaucoup plus forte et sa durée d’action est beaucoup plus longue. L’hCG est en outre impliquée dans de
nombreux processus qui permettent une bonne implantation de l’embryon.
Mots-clés
Hormone lutéinisante (LH)
Gonadotrophine
chorionique humaine
(hCG)
Fertilité
Stéroïdogenèse
Fécondation
in vitro
(FIV)
Keywords
Luteinizing Hormone (LH)
Human Chorionic
Gonadotropin (hCG)
Fertility
Steroidogenesis
In vitro fertilisation (IVF)

34 | La Lettre du Gynécologue • n° 350 - mars 2010
MISE AU POINT
Rôles respectifs de la LH
et de l’hCG
Activité LH, stéroïdogenèse
et folliculogenèse
En phase folliculaire précoce, la stéroïdogenèse
illustre la complémentarité de l’activité LH et de
la FSH (Follicle-Stimulating Hormone ou hormone
folliculo-stimulante) sur le complexe folliculo-ovocy-
taire. À ce stade, la production des estrogènes néces-
site la coopération des cellules de la thèque et de
celles de la granulosa, pourvues d’un équipement
enzymatique différent. Cette suite d’événements
hormonaux est connue sous le nom de “théorie bicel-
lulaire” (2 cellules-2 gonadotrophines) [figure 1].
Au cours de la première partie de la phase folliculaire,
la LH agit sur les cellules de la thèque interne, qui
expriment constitutivement à leur surface le récep-
teur LH/hCG-R, stimulant un complexe hydroxy-
lase-lyase capable de convertir la progestérone en
androgènes (16). Ces androgènes diffusent vers
les cellules de la granulosa, pourvues d’enzymes
à activité aromatase capables de transformer les
androgènes en estrogènes sous l’action de la FSH
(figure 1) [2, 16, 17].
La FSH donnée en début de cycle lance le signal
du recrutement folliculaire, entraîne la multipli-
cation et achève la différenciation des follicules
recrutés dans les cellules de la granulosa (figure 1)
[2, 15]. La granulosa devient alors compétente pour
synthétiser les estrogènes à partir d’androgènes.
Avec l’aromatisation des androgènes en estrogènes
en phase folliculaire tardive, l’activité LH prend le
relais de la FSH dans toutes ses actions et le statut
hormonal du follicule bascule vers un stade estro-
génique dominant (1, 3).
Des données issues d’études in vitro et d’études
cliniques chez l’homme montrent que l’activité LH
soutient de façon prépondérante le développement
et la maturation des plus gros follicules pourvus de
nombreux récepteurs à cette gonadotrophine (3).
Simultanément, les plus petits follicules (diamètre
inférieur à 10 mm) involuent, leur granulosa n’expri-
mant pas suffisamment de récepteurs à la LH pour
faire face à la déprivation en FSH (3). La produc-
tion thécale d’androgènes médiée par l’activité LH
contribue, avec le déclin des taux de FSH, à l’atrésie
et à l’apoptose des follicules les moins matures (2,
3, 17).
L’hCG, un marqueur décisif
de l’implantation embryonnaire
La réussite du processus implantatoire naturel
requiert deux acteurs principaux, l’endomètre
et l’embryon, tous deux dialoguant à l’interface
materno-fœtale ; le processus ne peut avoir lieu que
lors de la “fenêtre implantatoire” aux jours 20-24
du cycle menstruel. Le succès de l’implantation
embryonnaire est une étape cruciale de la repro-
duction assistée (FIV, ICSI...), qui implique des méca-
nismes moléculaires complexes faisant intervenir un
grand nombre d’effecteurs : des médiateurs solubles
(cytokines, interleukines, facteurs de croissance),
des molécules d’adhésion (intégrines, sélectines,
trophinines) et des enzymes protéolytiques de la
matrice externe (18).
Parmi les médiateurs de cette cascade, l’hCG
trophoblastique est le facteur le plus spécifique-
ment produit par l’embryon. L’hCG est aussi le signal
embryonnaire le plus précocement exprimé (dès le
stade 4-8 cellules) à l’interface materno-fœtale.
Grâce à sa production d’hCG, l’embryon orchestre
finement et contrôle (figure 2) [19] :
➤
l’augmentation de la durée de la fenêtre implan-
tatoire, via la réduction de l’IGFBP-1 (Insulin-like
Growth Factor Binding Protein 1) ;
Figure 1. La théorie bicellulaire (d’après 2 et 15).
Cellules
thécales
Cholestérol
Progestérone
Androgènes
▼
▼
Cellules
de la granulosa
Cholestérol
Progestérone
Androgènes
Estradiol
▼▼
▼
FSH
Androgènes
transférés
aux cellules
de la granulosa
A
A
A
AA
A
EE
E
E
E
Activité LH
Estradiol
Croissance
folliculaire
Maturation
ovocytaire
E
Références
bibliographiques
1. Fanchin R. Rôle revisité de la LH
sur le développement folliculaire.
Gynecol Obstet Fertil 2002;30:753-
64.
2. Lévy DP, Navarro JM, Schattman
G et al. The role of LH in ovarian
stimulation. Human Reprod
2000;15:2258-65.
3. Filicori M, Cognigni GE, Samara
A et al. The use of LH activity to
drive folliculogenesis: exploring
uncharted territories in ovula-
tion induction. Hum Reprod
2002;8:543-57.
4. Quang NT. À propos de l’exploration
de l’axe hypothalamo-hypophyso-
gonadique. Immuno-analyse et
Biologie Spécialisée 2003;18:35-40.
5. Perrier d’Hauterive S, Charlet-
Renard C, Dubois M, Foidart JM,
Geenen V. What’s new at the
maternal-foetal interface: role of
the hCG/LH-hCG receptor couple
during embryo implantation. Rev
Med Liege 2006;61:705-12.
6. Robertson DM, Damme MP, Dicz-
falusy E. Biological and immuno-
logical characterization of human
luteinizing hormone. Biological
profile in pituiary and plasma
samples after electrofocusing.
Mol Cell Endocrinol 1977;9:45-56.
7. Rao CV. Multiple novel roles of
luteinizing hormone. Fertil Steril
2001;76:1097-100.

La Lettre du Gynécologue • n° 350 mars 2010 | 35
MISE AU POINT
➤
l’implantation, via l’augmentation de LIF (Leukemia
Inhibitory Factor), la réduction d’IL-6 (Interleukine-6)
produite par l’épithélium, et le contrôle du M-CSF
(Macrophage Colony-Stimulating Factor) ;
➤
l’angiogenèse endométriale, par l’intermédiaire
du VEGF (Vascular Endothelial Growth Factor), dont
la production est augmentée sous l’effet de l’hCG et
qui permet l’élaboration d’un réseau vasculaire inhé-
rent au développement optimal du fœtus (figure 2) ;
➤
la tolérance immunitaire, via l’augmentation de
LIF et la diminution de l’IL-6, pour protéger l’allo-
greffe fœtale contre un rejet par le système immu-
nitaire maternel (figure 2) ;
➤
la restructuration de l’endomètre, dans la période
qui suit l’implantation embryonnaire, via l’augmenta-
tion de la production de MMP-9 (Matrix MetalloPep-
tidase 9) et l’inhibition des inhibiteurs tissulaires
des métalloprotéinases TIMP (Tissue Inhibitor of
MetalloProteinases).
Conclusion
Au côté de la FSH, l’activité LH provenant de la LH ou
de l’hCG joue un rôle déterminant en fertilité. Cette
action s’exerce sur le développement et la maturation
folliculaire, ainsi que sur la préparation de l’endo-
mètre et l’implantation embryonnaire. Si LH et hCG
sont extrêmement proches au niveau structural, un
grand nombre de différences pharmaco-chimiques
leur donne une signature biologique particulière :
– par sa liaison plus forte au récepteur LH/hCG-R,
l’hCG est un stimulus plus “robuste” que la LH ;
– l’hCG a une durée d’action plus longue que la LH
sur le récepteur LH/hCG-R ;
– l’hCG induit potentiellement des effets plus larges
que la LH, avec notamment une action au niveau
de l’utérus et des vaisseaux. L’hCG pourrait avoir
un rôle direct dans le processus implantatoire en
agissant sur de nombreuses cascades, impliquant
de nombreux effecteurs.
L’assistance médicale à la procréation évolue
de jour en jour : le nouveau défi est d’élucider le
tableau complet des différents acteurs d’une bonne
fenêtre implantatoire et d’identifier un ou plusieurs
biomarqueurs, fiables, incontournables, facilement
mesurables en clinique, de préférence de façon non
invasive.
Dans ce contexte de recherche, l’hCG pourrait
constituer le signal embryonnaire spécifique, étant
responsable de plusieurs signaux moléculaires trans-
duits dans l’endomètre par l’intermédiaire de son
récepteur LH/hCG-R. ■
Récepteur LH/hCG-R
hCG
Endomètre
LIF
IL-6
VEGF
LIF
IL-6
Enfouissement de l’embryon
dans la paroi utérine
Élaboration d’un réseau
vasculaire permettant
le développement optimal
du fœtus
Protection de l’allogreffe
fœtale contre un rejet
par le système immunitaire
maternel
Tolérance Angiogenèse Implantation
.....
.....
.....
.....
.....
.....
.....
.....
.....
Figure 2. Rôle de l’hCG trophoblastique et du récepteur LH/hCG dans l’implantation
embryonnaire.
8. Licht P, Russu V, Lehmeyer S, Wildt L. Molecular aspects of direct LH/hCG effects on human endometrium-
lessons from intra-uterine microdialysis in the human female in vivo. Reprod Biol 2001;1:10-19.
9. Tesarik J. Luteinizing hormone affects uterine receptivity independently of ovarian function. RBM Online
2003;7:59-64.
10. Kovalevskaya G, Birken S, Kakuma T et al. Differential expression of human chorionic gonadotropin (hCG)
glycosylation isoforms in failing and continuing pregnancies: preliminary characterization of the hypergly-
cosylated hCG epitope. J Endocrinol 2002;172:497-506.
11. Simoni M, Tüttelmann F, Michel C et al. Polymorphisms of the luteinizing hormone/chorionic gonado-
tropin receptor gene: association with maldescended testes and male infertility. Pharmacogenet Genomics
2008;18:193-200.
12. Roess DA, Jewell MA, Philpott CJ et al. The rotational diffusion of LH receptors differs when receptors
are occupied by hCG versus LH an is increased by cytochalasin D. Biochim Biophys Acta 1997;1357:98-106.
13. Segaloff DL, Puett D, Ascoli M. The dynamics of the steroidogenic response of perifused Leydig tumor
cells to human chorionic gonadotropin, ovine luteinizing hormone, cholera toxin, and adenosine 3’, 5’-cyclic
monophosphate. Endocrinology 1981;108:632-8.
14. Bourdage RJ, Fitz TA, Niswender GD. Differential steroidogenic responses of ovine luteal cells to ovine
luteinizing hormone and human chorionic gonadotropin. Proc Soc Exp Biol Med 1984;175:483-6.
15. Kobayashi M, Nakano R, Ooshima A. Immunohistochemical localization of pituitary gonadotropins and
gonadal steroids confirms the ‘two-cell, two-gonadotrophin’ hypothesis of steroidogenesis in the human
ovary. J Endocrinol 1990;126:483-8.
16. Hugues JN, Cedrin-Durnerin I. Le rôle de l’hormone lutéinisante dans la physiologie du follicule et du
corps jaune. Gynecol Obstet Fertil 2000;28:738-44.
17. Drummond AE. The role of steroids in follicular growth. Reprod Biol Endocrinol 2006;4:16.
18. Perrier d’Hauterive S et al. Y a-t-il un marqueur décisif de l’implantation embryonnaire ? Med Reprod
2007;9:389-98.
19. Licht P, Fluhr H, Neuwinger J et al. Is human chorionic gonadotropin directly involved in the regulation
of human implantation? Mol Cell Endocrinol 2007;269:85-92.
Références bibliographiques
1
/
4
100%