Constitution de l`atome - les ions

1
Cours sciences physiques, François EMOND – Classe de troisième
Constitution de l’atome - les ions
1. Constitution de l’atome : généralités
Toute matière dans l’univers est constituée d’atomes.
A ce jour on connait 118 éléments qui peuvent être considérés comme étant les « briques » élémentaires à
partir desquelles est structurée toute la matière.
Les atomes sont des particules électriquement neutre extrêmement petites : le diamètre d’un atome vaut
environ 0,1 nm.
(On rappelle que 1 nanomètre (symbole : nm) vaut 10-9 m… soit un milliardième de mètre ou encore un
millionième de millimètre).
il faudrait aligner 50000 atomes pour avoir le diamètre d’un cheveu.
Un atome est constitué d’un noyau chargé positivement et d’un nuage électronique, constitué d’électrons
(symbole : e-), chargé négativement.
noyau (chargé positivement)
Atome (électriquement neutre)
nuage électronique (chargé négativement)
Le noyau est, quant-à lui, 100000 (=105) fois plus petit que l’atome (si on représentait le noyau par un point
de 1 mm de diamètre, alors l’atome serait représenté, dans ces conditions, par une sphère de 100000 mm =
100 m de de diamètre !!). Par ailleurs, la masse de l’atome est principalement due à celle de son noyau.
on en déduit qu’à l’échelle microscopique la matière est essentiellement constituée de vide : on dit que
la matière à une structure lacunaire.
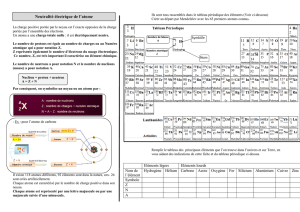
Chaque élément peut être caractérisé par son numéro atomique Z qui représente le nombre d’électrons
contenu dans un atome de cet élément (on trouve la valeur de Z, pour chacun de éléments connus, dans la
« classification périodique des éléments »… cf. par exemple la page de rabat de la couverture à la fin du livre
de cours) .
Exemple 1 : atome d’aluminium Al (Z = 13)
cet atome possède un nuage électronique constitué de Z = 13 électrons… puisqu’il est électriquement
neutre on peut affirmer que son noyau contient 13 charges positives, soit autant de charges positives dans le
noyau que de charges négatives dans le nuage électronique. On peut donc représenter schématiquement
l’atome d’aluminium de la façon suivante :
Exemple 2 : atome de sodium Na (Z = 11)
cet atome possède un nuage électronique constitué de Z = 11 électrons… puisqu’il est électriquement
neutre on sait que son noyau contient 11 charges positives. On peut donc représenter schématiquement
l’atome de sodium de la façon suivante :
noyau
13+
nuage électronique : 13 e-
atome d’aluminium
Z =13

2
Cours sciences physiques, François EMOND – Classe de troisième
Remarque : les atomes peuvent être considérés comme de petites sphère dures…
2. Les ions
Les ions sont des atomes (ions monoatomiques) ou des assemblages d‘atomes (ions polyatomiques) ayant
perdus ou gagnés un ou plusieurs électrons. Ce sont donc des particules chargées.
anions : charges négatives (exemple : ion fluorure F -, ion nitrate N -, ion sulfate S -, …)
cations : charges positives (exemple : ion sodium Na+, ion calcium Ca2+, ion ammonium N , …)
Remarque : en chimie le noyau ne peut jamais être modifié… seuls les électrons peuvent être échangés (les
modifications du noyau ne sont possibles qu’en physique nucléaire, ce qui ne sera jamais envisagé au collège).
Exemple 1 : considérons le cation sodium Na+ (la charge + signifie que, par rapport à l’atome de sodium,
électriquement neutre, l’ion sodium a perdu un électron), on peut le représenter de la façon suivante :
Exemple 2 : considérons le cation aluminium Al3+ (la charge 3+ signifie que, par rapport à l’atome
d’aluminium, électriquement neutre, l’ion aluminium a perdu trois électrons), on peut le représenter de la
façon suivante :
Exemple 3 : considérons l’anion chlorure Cl - (la charge - signifie que, par rapport à l’atome de chlore,
électriquement neutre, l’ion chlorure a gagné un électron), on peut le représenter de la façon suivante :
noyau
11+
nuage électronique : 11 e-
atome de sodium
Z =11
ions
cation sodium
Z =11
11+
noyau
nuage électronique : 17 +1 = 18 e-
nuage électronique : 11 - 1 = 10 e-
noyau
cation aluminium
Z =13
noyau
13+
nuage électronique : 13 - 3 = 10 e-
anion chlorure
Z =17
17+
1
/
2
100%