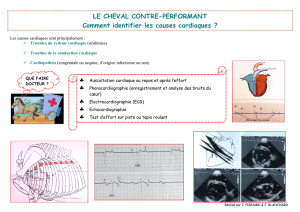
Le Cœur Numérique Le cœur est un organe - Serpico

!"#$%&'#(&)*'+,&"#
#
!"#-%&'#"./#&0#1'230"#-1)45"6"#710/#53#810-/+10#"./#793..&'"'#53#-+'-&53/+10#7&#.302#730.#
591'230+.)":#;5#"./#-10./+/&*#7&#-%&'#7'1+/#"/#7&#-%&'#23&-<"=#-<3-&0#*/30/#81')*#7"#7"&6#-3>+/*.#?#&0"#
1'"+55"//"#"/#&0#>"0/'+-&5":#!"#>"0/'+-&5"#7'1+/#"0>1+"#5"#.302#>"'.#5".#41&)10.#/307+.#,&"#5"#23&-<"#."#
-<3'2"#7935+)"0/"'#5"#'"./"#7&#-1'4.=#-"//"#*@"-/+10#'*.&5/30/#7"#53#-10/'3-/+10#7&#)A1-3'7"#B/+..&#
-3'7+3,&"C:##
$"//"#7".-'+4/+10#"./#D#4'*."0/#-100&"#7"#/1&.#)3+.#5"#'E5"#7&#-%&'#730.#5"#-1'4.#<&)3+0#"./#'"./*#
5102/")4.#)A./*'+"&6:#F&'30/#5930/+,&+/*=#5".#2'"-.#A#51-35+.3+"0/#5".#)30+8"./3/+10.#7"#59G)"#4&+.,&"#53#
8'*,&"0-"#7".#H3//")"0/.#7&#-%&'#"./#-1''*5*"#3>"-#5".#*)1/+10.#'".."0/+".:#I35"0#"/#.".#7+.-+45".#3&#
;;J)"#.+J-5"#10/#-1''"-/")"0/#7+./+02&*#5".#K#'*."3&6#.302&+0.=#3'/*'+"5.#"/#>"+0"&6=#)3+.#'"0730/#5".#
."&5".#3'/J'".#'".410.3H5".#7"#53#-+'-&53/+10#7&#.302=#5"#-%&'#*/30/#>&#-1))"#&0#3.4+'3/"&'#7&#.302#45&/E/#
,&9&0"#41)4":#L&#MJ)"#.+J-5"=#L>+-"00"=#)*7"-+0N4<+51.14<"#791'+2+0"#4"'."=#7*-'+/#5"#'E5"#7".#
>"0/'+-&5".#"/#7".#>35>".#-3'7+3,&".=#)3+.#-"#8&/#;H0#35N(38+.=#.3>30/#&0+>"'."5#3'3H"#7&#M;;J)"#.+J-5"=#,&+#
7*-1&>'+/#53#-+'-&53/+10#.302&+0"=#"0#43'/+-&5+"'#7"#53#-+'-&53/+10#4&5)103+'":#O0#1--+7"0/=#P#.+J-5".#45&.#
/3'7=#Q+55+3)#R3'>"A#-1)45*/3#5".#/'3>3&6#7"#;H0#35N(38+.#"0#)"//30/#"0#*>+7"0-"#5"#'E5"#7".#-34+553+'".#"/#
"0#83+.30/#&0"#3035A."#,&30/+/3/+>"#7"#53#810-/+10#-3'7+3,&":##
!3#-1003+..30-"#7"#53#4<A.+1512+"#7&#-%&'#3#83+/#7".#4'12'J.#-10.+7*'3H5".#7"4&+.#5"#MS;;J)"#
.+J-5"=#5"#.+J-5"#7"#R3'>"A#"/#7"#!1&+.#M;S:#$10.*,&"0-"#41.+/+>"#7"#-"#4'12'J.=#53#4'+."#"0#-<3'2"#7".#
)3537+".#-3'7+1>3.-&53+'".=#4'")+J'"#-3&."#7"#)1'/35+/*#"0#1--+7"0/=#"./#"0#43'/+"#'".410.3H5"#7"#
59355102")"0/#7"#59".4*'30-"#7"#>+"=#+08*'+"&'"#D#KP#30.#3&#MS;;J)"#"/#.&4*'+"&'"#D#TU#30.#D#4'*."0/:#O0#
V'30-"=#10#7*01)H'"#-"4"0730/#"0-1'"#,&"5,&"#WPU#UUU#)1'/.#43'#30#791'+2+0"#-3'7+1>3.-&53+'"=#.1+/#&0#
/+"'.#7)H'"#/1/35#7"#7*-J.:#L8+0#793)*5+1'"'#5"#7+3201./+-#"/#53#/<*'34+"#7"#-".#)3537+".#)3+.#3&..+#
79344'18107+'#53#-1003+..30-"#7"#53#810-/+10#-3'7+3,&"=#&0"#01&>"55"#7+.-+45+0"#.-+"0/+8+,&"#.9"./#
7*>"5144*"#7"4&+.#4'*.#79&0"#>+02/3+0"#79300*"#?#53#)17*5+.3/+10#0&)*'+,&"#7&#.A./J)"#-3'7+1>3.-&53+'":#
!91H@"-/+8#7"#-".#)17J5".#"./#7"#81&'0+'#&0"#7".-'+4/+10#)3/<*)3/+,&"=#,&30/+/3/+>"=#1H@"-/+>"#"/#
/'+7+)"0.+100"55"#7"#53#810-/+10#-3'7+3,&"#,&+#.1+/#-1)45*)"0/3+'"#7"#-"55"#5+//*'3+'"=#,&35+/3/+>"#"/#
2'34<+,&"#&/+5+.*"#/'37+/+100"55")"0/#730.#53#81')3/+10#)*7+-35":##
X+"0#.&'=#)"//'"#3)+0/#&0"#/"55"#7".-'+4/+10#&0+>"'."55"#'"5J>"#7"#59&/14+"#/30/#53#)3-<+0"#
-3'7+3,&"#"./#-1)45"6":#Y1&/#793H1'7=#-+/10.#-1))"#.1&'-"#7"#-1)45"6+/*#5"#83+/#,&"#45&.+"&'.#
4<*01)J0".#4<A.+,&".#"/#-<+)+,&".#"0/'"0/#"0#@"3'.#79&0#H3//")"0/#-3'7+3,&":#O0#"88"/=#53#-10/'3-/+10#
"./#-10/'E5*"#43'#53#4'14323/+10=#7".#1'"+55"//".#3&6#>"0/'+-&5".=#79&0"#107"#7+/"#7"#7*4153'+.3/+10#
*5"-/'+,&"#?#-"55"N-+#"./#+07&+/"#43'#53#7*4153'+.3/+10#7"#4'1-<"#"0#4'1-<"#7".#-"55&5".#)&.-&53+'".#B43..32"#
79&0#41/"0/+"5#0*23/+8#D#&0"#>35"&'#41.+/+>"C=#,&+#"0.&+/"#."#'"4153'+."0/=#"/#3+0.+#7"#.&+/":#!3#-343-+/*#7&#
/+..&#-3'7+3,&"#D#."#-10/'3-/"'#7*4"07#3&..+#7"#593441'/#B4"'8&.+10C#7916A2J0"#3&6#-"55&5".#43'#5".#3'/J'".#
-1'103+'".:#O08+0=#53#4'"..+10#"/#5"#7*H+/#7&#.302#730.#5".#3'/J'".=#5".#>"+0".#"/#5".#-3>+/*.#-3'7+3,&".#D#53#
81+.#-1))307"0/#"/#'*.&5/"0/#7"#53#-10/'3-/+10#"/#'"5363/+10#7&#)&.-5"#-3'7+3,&":#Y1&.#-".#4<*01)J0".#
4<A.+,&".#B*5"-/'14<A.+1512+"=#4"'8&.+10=#)*-30+,&"#7".#85&+7".#"/#7".#./'&-/&'".C#.10/#710-#+0/+)")"0/#
-1&45*.#5".#&0.#3>"-#5".#3&/'".#"/#.10/#".."0/+"5.#D#53#-1)4'*<"0.+10#7&#.A./J)"#-3'7+1N>3.-&53+'":#
Z0"#3&/'"#.1&'-"#7"#-1)45"6+/*#"./#,&"#5".#4'+0-+4".#4<A.+-1N-<+)+,&".#+)45+,&*.#+0/"'>+"00"0/#
D#7".#*-<"55".#7"#/")4.#"/#79".43-"#/'J.#*/"07&".:#[3'#"6")45"=#41&'#-1)4'"07'"#5".#/'1&H5".#7&#'A/<)"#
-3'7+3,&"=#+5#"./#+07+.4"0.3H5"#7"#H+"0#-1)4'"07'"#5".#)+2'3/+10.#79+10.#,&+#+0/"'>+"00"0/#3�+>"3"#53#
-"55&5"#-3'7+3,&"#710/#53#/3+55"#"./#7"#591'7'"#7"#45&.+"&'.#)+-'10.#BWUN\#)C:#[3'#-10/'"=#5".#'*2+10.#7&#-%&'#
35/*'*".#.&+/"#D#&0#+083'-/&.#7&#)A1-3'7"#10/#&0"#/3+55"#7"#591'7'"#7&#-"0/+)J/'"#BWUNK#)C:#F"#)])"=#5"#
-A-5"#-3'7+3,&"#3#&0"#7&'*"#7"#591'7'"#7"#53#."-107"#)3+.#59*>15&/+10#7"#53#81')"#7&#-%&'#.&+/"#D#&0"#
+0/"'>"0/+10#-<+'&'2+-35"#B4<*01)J0"#344"5*#'")17"532"C#.9*/3H5+/#.&'#45&.+"&'.#.")3+0".:##
O08+0=#5"#7"'0+"'#1H./3-5"#D#.&')10/"'#41&'#53#)17*5+.3/+10#0&)*'+,&"#7&#-%&'#"./#59+08+0+"#
>3'+3H+5+/*#7"#81')"#"/#7"#-1)41'/")"0/#,&+#"6+./"#"0/'"#5".#+07+>+7&.#"0#'3+.10#7"#53#2*0*/+,&"#)3+.#3&..+#
7"#53#4'*."0-"#7"#)3537+".#-3'7+3,&".:#^352'*#-".#7+88+-&5/*.=#5".#/'3>3&6#7"#'"-<"'-<"#.&'#53#)17*5+.3/+10#
4<A.+,&"#"/#4<A.+1512+,&"#7&#-%&'#10/#7*H&/*#+5#A#3#4'*.#7"#,&3'30/"#30.#3&#."+0#7"#59&0+>"'.+/*#79_681'7#
"0#I'307"NX'"/320"#3+0.+#,&9D#59+0./+/&/#7"#X+1"02*0+"'+"#7"#59&0+>"'.+/*#79L&-`5307#"0#(1&>"55"Na*5307":#
;5.#."#.10/#3)45+8+*.#7"4&+.#730.#45&.+"&'.#3&/'".#-"0/'".#7"#'"-<"'-<"#710/#-"5&+#7"#59;(b;L#"0#V'30-"#3&#
."+0#7"#593-/+10#$3'7+1c"0."dF#530-*"#"0#KUUP:#!".#1H@"-/+8.#A#.10/#D#53#81+.#45&.#)17"./".#"/#45&.#-+H5*.#
,&"#-"&6#*010-*.#4'*-*7"))"0/:#[5&/E/#,&"#7"#7*-'+'"#7"#)30+J'"#&0+>"'."55"#5"#810-/+100")"0/#7&#
-%&'=#10#."#-10-"0/'"#4'+0-+435")"0/#.&'#5".#4<*01)J0".#*5"-/'+,&".#"/#)*-30+,&".#,&+#+0/"'>+"00"0/#D#
59*-<"55"#)3-'1.-14+,&"#BD#59*-<"55"#7".#/+..&.#"/#010#7"#53#-"55&5"C:#F"#45&.=#"0#>&"#793)*5+1'"'#5"#
7+3201./+-#"/#53#/<*'34+"#7"#)3537".#.1&88'30/#7"#)3537+".#-3'7+1>3.-&53+'".=#10#-<"'-<"#D#4"'.10035+."'#
-".#)17J5".#0&)*'+,&".=#-e"./NDN7+'"#D#'"4'*."0/"'#5"#-%&'#79&0#43/+"0/#D#43'/+'#7"#7100*".#3-,&+.".#51'.#
79"63)"0.#-5+0+,&".:#[3'#"6")45"=#53#8'*,&"0-"#-3'7+3,&"#"/#53#4'"..+10#.302&+0"#.10/#-1&'3))"0/#

3-,&+.".#51'.#79&0#"63)"0#)*7+-35#"/#81&'0+.."0/#7".#'"0."+20")"0/.#,&30/+/3/+8.#.&'#5"#851/#.302&+0#"/#5"#
H3//")"0/#7&#-%&'#79&0#43/+"0/:#F"#)])"=#59+)32"'+"#*-<12'34<+,&"=#.-300"'#1+'#'*.1030-"#
)320*/+,&"#81&'0+.."0/#7".#+081')3/+10.#"0#/'1+.#7+)"0.+10.#.&'#59303/1)+"#7&#-%&'#"/#7".#>3+.."3&6#
.302&+0.#)3+.#3&..+#.&'#5"#)1&>")"0/#-3'7+3,&":#O08+0=#59*5"-/'1-3'7+12'3))"#1&#"0-1'"#59"6451'3/+10#
*5"-/'14<A.+1512+,&"#43'#-3/<*/"'.#4"')"//"0/#7"#-1003f/'"#53#81')"#"/#53#>+/".."#7".#107".#*5"-/'+,&".#
43'-1&'30/#5"#-%&':#
L+0.+=#"0#810-/+10#79<A41/<J.".#.&'#53#-107+/+10#7&#-%&'#79&0#43/+"0/=#10#"0#-10./'&+/#&0#)17J5"#
0&)*'+,&"#"0#.93+730/#7".#7100*".#7+.410+H5".:#!"#4'")+"'#1H@"-/+8#7&#)17J5"#"./#7"#'"4'17&+'"#
8+7J5")"0/#5".#1H."'>3/+10.#>+.+H5".#730.#5".#+)32".#)*7+-35".:#!"#."-107#1H@"-/+8=#45&.#3)H+/+"&6=#"./#
79&/+5+."'#-"#)17J5"#41&'#4'*7+'"#59*>15&/+10#7"#)3537+".#-3'7+3,&".#1&#"0-1'"#7"#)+"&6#4530+8+"'#&0"#
+0/"'>"0/+10#/<*'34"&/+,&"#B-<+'&'2+"=#4'+."#7"#)*7+-3)"0/.gC:#
[1&'#)"//'"#"0#%&>'"#&0#)17J5"#0&)*'+,&"#7&#-%&'=#+5#83&/#/1&/#793H1'7#7*8+0+'#&0#71)3+0"#7"#
-35-&5#.1&.#53#81')"#79&0#)3+5532"#/'+7+)"0.+100"5:#$"#)3+5532"#"./#'"-10./'&+/#D#43'/+'#79+)32".#)*7+-35".#
7+/+"0/#"/#.3#/3+55"#>3'+"#7"#,&"5,&".#7+h3+0".#7"#)+55+"'.#D#,&"5,&".#)+55+10.#79*5*)"0/.#.&+>30/#53#
03/&'"#7".#4<*01)J0".#,&"#5910#-<"'-<"#D#.+)&5"':#c&'#-"#)3+5532"=#+5#"./#0*-"..3+'"#7"#'3@1&/"'#7".#
+081')3/+10.#303/1)+,&".#-1))"#59")453-")"0/#7".#>35>".#-3'7+3,&".#1&#"0-1'"#591'+"0/3/+10#7".#8+H'".#
-3'7+3,&".:#O0#"88"/=#5"#-%&'#"./#&0#)&.-5"#-10./+/&*#7"#)+0&.-&5".#8+H'".#,&+#."#-10/'3-/"0/#"/#."#
'"5G-<"0/#7&'30/#5"#-A-5"#-3'7+3,&":#$".#8+H'".#.9"0'1&5"0/#3&/1&'#7".#-3>+/*.#-3'7+3,&".#"/#5"&'#./'&-/&'"#
@1&"#&0#'E5"#+)41'/30/#41&'#53#)*-30+,&"#"/#59*5"-/'14<A.+1512+"#-3'7+3,&":##
O0#45&.#7"#-"#71)3+0"#7"#-35-&5=#10#7*8+0+/#7".#*,&3/+10.#)3/<*)3/+,&".#,&+#'"4'*."0/"0/#5".#
4<*01)J0".#4<A.+,&".#2*0*'35")"0/#-1&45*.#,&"#5910#.1&<3+/"#*/&7+"':#$".#*,&3/+10.#7*8+0+.."0/#
-1))"0/#-"'/3+0".#>3'+3H5".=#-1))"#5"#41/"0/+"5#*5"-/'+,&"#15#41.+/+10#79&0#41+0/#7&#>"0/'+-&5"#23&-<"=#
*>15&"0/#3&#-1&'.#7&#-A-5"#-3'7+3,&":#X+"0#.&'=#5".#*,&3/+10.#+0-5&"0/#7".#43'3)J/'".#/"5.#,&"#53#
7+88&.+>+/*#*5"-/'+,&"#15#'3+7"&'#7&#)&.-5"#710/#53#>35"&'#+085&"0-"#59*>15&/+10#7".#2'307"&'.#4<A.+,&".:#
$".#*,&3/+10.#.10/#"0.&+/"#7+.-'*/+.*".#.&'#5"#71)3+0"#7"#-35-&5#"/#.10/#'*.15&".#43'#1'7+03/"&':#[1&'#
.+)&5"'#5".#,&3/'"#4<3.".#B'")45+..32"=#-10/'3-/+10=#*@"-/+10#"/#'"5363/+10C#79&0#."&5#H3//")"0/#7&#-%&'#
710/#53#7&'*"#"./#7"#591'7'"#7"#53#."-107"=#+5#83&/#"0/'"#WU#)+0&/".#"/#45&.+"&'.#<"&'".#7"#-35-&5#"0#810-/+10#
7"#53#-1)45"6+/*#7&#)17J5":#[1&'#4"'.10035+."'#5"#)17J5"=#+5#83&/#"08+0#"./+)"'#5".#43'3)J/'".#7".#
*,&3/+10.#38+0#,&"#53#.+)&53/+10#-1''".4107"#3&6#1H."'>3/+10.#7+.410+H5".#41&'#&0#43/+"0/#7100*:#$9"./#
&0#4'1H5J)"#7+88+-+5"#-3'#+5#"./#<1'.#7"#,&"./+10#7"#/"./"'#/1&/".#5".#-1)H+03+.10.#7"#43'3)J/'".#41..+H5".:#
F91i#59+7*"#7"#83+'"#344"5#D#7".#)*/<17".#793..+)+53/+10#7"#7100*".#45&.#-1&'3))"0/#&/+5+.*".#730.#
793&/'".#71)3+0".#/"5.#,&"#53#)*/*1'1512+":#O55".#-10.+./"0/#D#388+0"'#5"#)17J5"#7"#)30+J'"#+/*'3/+>"#
@&.,&9D#)+0+)+."'#59*-3'/#"0/'"#5".#,&30/+/*.#.+)&5*".#"/#5".#,&30/+/*.#1H."'>*".#?#>15&)"#7"#.302#*@"-/*=#
*5"-/'1-3'7+12'3))"=#"/-##
!3#>35+73/+10#7"#/"5.#)17J5".#"./#&0#/'3>3+5#7"#5102&"#<35"+0"#,&+#)1H+5+."#7".#"64"'/.#"0#
+081')3/+,&"=#/'3+/")"0/#79+)32".=#)3/<*)3/+,&".#3445+,&*".#)3+.#3&..+#7".#)*7"-+0.#-3'7+1512&".:#Z0"#
4'")+J'"#*/34"#7"#-"//"#>35+73/+10#-10.+./"#D#.+)&5"'#0&)*'+,&")"0/#5"#H3//")"0/#7&#-%&'#730.#7".#
.+/&3/+10.#01')35".#"/#"0#4'*."0-"#7"#43/<1512+".#-3'7+3,&".#4&+.#7"#>*'+8+"'#,&9+5#A#3#&0"#H100"#
37*,&3/+10#"0/'"#5"#-1)41'/")"0/#.+)&5*#"/#-"5&+#7*-'+/#43'#5".#"64"'/.#"0#-3'7+1512+":#Z0"#."-107"#*/34"#
4"')"/#7"#/"./"'#5"#-3'3-/J'"#4'*7+-/+8#7&#)17J5":#[1&'#-"53=#10#4"'.10035+."#&0#)17J5"#7&#-%&'#D#43'/+'#
7"#7100*".#B+)32".#"/#.+203&6#H+1N*5"-/'+,&".C#79&0#43/+"0/#"/#10#4'*7+/#5"#-1)41'/")"0/#-3'7+3,&"#
51'.,&"#-"5&+N-+#"./#.1&)+.#D#&0"#/<*'34+"#1"#01&>"3&6#./+)&5+:#[3'#"6")45"=#&0"#4'1-*7&'"#-1&'30/"#
"0#-3'7+1512+"#-10.+./"#D#./+)&5"'#3'/+8+-+"55")"0/#5"#-%&'#D#593+7"#7"#.107".#7"#./+)&53/+10#B344"5*".#3&..+#
43-")3`"'.C:#F".#/'3>3&6#'*-"0/.#"88"-/&*.#43'#59;(b;L#"/#59<E4+/35#c/#Y<1)3.#7"#!107'".=#10/#3+0.+#4&#
)10/'"'#.&'#&0#4"/+/#01)H'"#7"#43/+"0/.#,&9&0#)17J5"#*5"-/'1N)*-30+,&"#7&#-%&'#41&>3+/#4'*7+'"#5"#
-1)41'/")"0/#)*-30+,&"#7&#-%&'#'*.&5/30/#7"#./+)&53/+10.#3'/+8+-+"55".:#
L#/"')"=#&0"#3445+-3/+10#7"#-".#/'3>3&6#41&''3+/#710-#]/'"#5914/+)+.3/+10#7"#53#41."#7"#
./+)&53/"&'.#-3'7+3,&".#)3+.#3&..+#&0"#)"+55"&'"#.*5"-/+10#7".#43/+"0/.#.&.-"4/+H5".#7"#H*0*8+-+"'#7"#-"//"#
/<*'34+":#F93&/'".#3445+-3/+10.#.10/#"0>+.32*".#/"55"#,&"#53#)"+55"&'"#4'+."#"0#-<3'2"#7"#43/+"0/.#.1&88'30/#
7"#/'1&H5".#7&#'A/<)"#2'G-"#D#&0"#4530+8+-3/+10#45&.#4'*-+."#7"#593H53/+10#'37+18'*,&"0-"#7"#/+..&.#
-3'7+3,&".:#

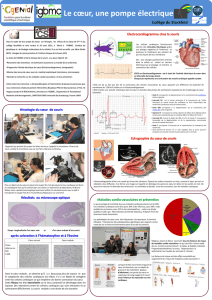
Le cœur est un muscle constitué de minuscules fibres appelées myocytes. Ces
structures allongées sont organisées de manière à maximiser l’éjection du sang depuis
les ventricules lors de la contraction cardiaque. Ainsi, ces fibres ont une orientation
qui varie entre la surface externe et interne des ventricules et elles s’enroulent autour
du grand axe du cœur. Il est à présent possible d’observer cette structure des fibres
grâce à l’imagerie par résonance magnétique (IRM) et en particulier l’imagerie dite
de «tenseur de diffusion». La figure ci-dessus correspond à un traitement
informatique de ces images acquises sur des cœurs canins.
Reconstruction tridimensionnelle de maillages volumiques des 2
ventricules cardiaques (D) à partir d’une image par résonance
magnétique (IRM) du cœur (A). Après une étape de correction
d’intensité (B), les cavités cardiaques sont isolées dans l’image (C).

Simulation de la contraction des 2 ventricules
cardiaques depuis la phase de remplissage (A et D) vers
la phase d’éjection (C et F). La carte de couleur
correspond à l’état de contraction active des fibres
cardiaques.
Simulation de l’activité électrique dans les 2 ventricules
cardiaques. (Gauche et milieu) Carte indiquant le temps de
passage de l’onde de dépolarisation, les couleurs chaudes
indiquant le lieu où la dépolarisation est la plus précoce. (Droit)
Forme de l’onde de dépolarisation se propageant dans les 2
ventricules.

1
/
5
100%