Document 1. De l`atome aux particules 1ère S ATOMES ET

Document 1. De l’atome aux particules
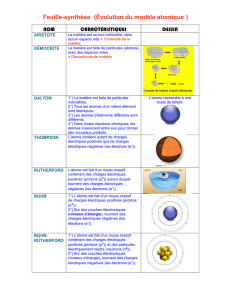
ARISTOTE croyait que la matière était continue, c’est-à-dire
que l’on pouvait diviser un bout de matière en morceaux de
plus en plus petits, à l’infini : on ne pourrait jamais tomber
sur un grain de matière qui ne pourrait plus être divisé.
Quelques Grecs, cependant, comme DEMOCRITE, tenaient
que la matière était granuleuse en soi et que tout était fait
d’un grand nombre de différentes sortes d’atomes. […] Le
débat entre les deux écoles de pensée ne fut réellement clos
en faveur des atomistes que dans les premières années de ce
siècle. […] A ce moment-là, on soupçonnait déjà que ces
atomes n’étaient peut-être pas insécables, après tout.
J.J. THOMSON avait démontré l’existence d’une particule de
matière, appelée électron, qui avait une masse de moins du
millième de celle de l’atome le plus léger. […] En 1911,
finalement, le physicien britannique Ernest RUTHERFORD
montra que les atomes de matière ont bien une structure
interne : ils sont faits d’un noyau extrêmement petit,
chargé positivement, autour duquel tournent un certain
nombre d’électrons.
D’abord, on estima que le noyau de l’atome était fait
d’électrons et d’un certain nombre variable de particules
chargées positivement appelées protons, d’après le mot grec
signifiant « premier », parce qu’on pensait que c’était
l’élément fondamental constituant la matière. Cependant,
en 1932, un collègue de RUTHERFORD à Cambridge, James
CHADWICK, découvrit que le noyau comprenait une autre
particule, appelée le neutron, qui avait à peu près la même
masse que le proton, mais pas de charge électrique.
d’après Stephen Hawking, « Une brève histoire du temps », Ed. Flammarion (1989)
PHYSIQUE - CHIMIE
1
ère S
ATOMES ET PARTICULES
Les constituants de la matière
Chap. 2.1
Activité 2
Né au IVe siècle av. J.C., puis utilisé aux XVIIIe-XIXe siècles pour expliquer la
structure des composés chimiques, l’atome prend corps dès le début du XXe
siècle. Mais on y découvre qu’il n’est plus insécable : il contient des particules,
protons et électrons. Mais la masse de l’ensemble protons-électrons ne
correspond pas à la réalité : les atomes semblent plus lourds.
Cette énigme est résolue en 1932 lorsque le britannique CHADWICK met en
évidence dans le noyau une autre particule, qu’il appelle neutron.
Cette découverte mènera entre autres à la réalisation de réactions de fission
et à la création de la bombe atomique.
Il recevra le prix Nobel de physique en 1935 pour la découverte du neutron.
Sir James CHADWICK
(1891-1974)
EXPLOITATION
1) Décrire la structure de l’atome connue à
l’époque de CHADWICK (premier quart du
XXe siècle).
2) Un atome est habituellement représenté par
le symbole
Z
AX
. Comment s’appellent les
nombres A et Z ? Que représentent-ils ?
3) Indiquer dans un tableau les caractéristiques
(taille, masse, charge en fonction de la charge
élémentaire e = 1,6
10-19 C) des particules
contenues dans le noyau.
4) Définir le terme isotope.
Donner le symbole des deux isotopes du
chlore cités dans le document 2 (ZCl = 17).
Ces isotopes ont-ils des propriétés chimiques
et physiques similaires ?
5) Montrer, sans calcul numérique, que la masse
d’un atome est concentrée dans son noyau.
Document 2. De l’atome aux isotopes
Il apparut que certains des radioéléments (éléments
possédant des propriétés radioactives spécifiques) ne
pouvaient pas être séparés chimiquement : ils
appartenaient clairement à la même espèce chimique.
SODDY parvint au début de 1911 à la conclusion qu’un
même élément chimique pouvait donc se présenter sous la
forme d’atomes ayant des poids atomiques différents. Deux
ans plus tard il appela « isotopes » ces atomes
chimiquement identiques mais de masse différente.
Après que SODDY eut proposé l’existence d’isotopes,
Francis William ASTON confirma l’existence de deux
isotopes du néon, auxquels il put attribuer les poids
atomiques de 20 et 22. […] Dès 1919 ASTON inventa et
construisit un « spectrographe à rayons positifs », le
premier spectrographe de masse, qui permettait de séparer,
sous l’effet d’un champ électrique puis magnétique, des
ions de même charge mais de masse différente.
Il mesura ainsi à nouveau avec une bien meilleure
précision les poids atomiques des isotopes du néon (20,00 et
22,00). Il découvrit aussi que le chlore, dont le poids
atomique admis était de 35,46, était en réalité constitué de
deux isotopes de poids atomiques 35 et 37. Finalement
ASTON mit en évidence plus de 212 isotopes d’éléments
stables. Le fait le plus remarquable était que leurs poids
atomiques relatifs étaient tous, à très peu près, des nombres
entiers (appelés par la suite « nombre de masse », désignés
par la lettre « A »).
d’après Pierre Radvanyi, « Histoire de l’atome. De l’intuition à la réalité », Ed. Belin (2007)
1
/
1
100%