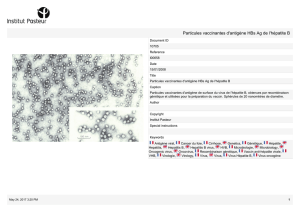
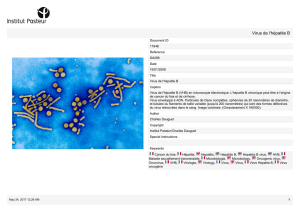
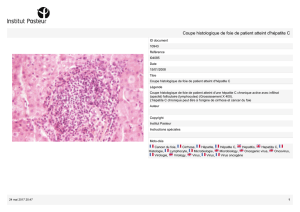
Hépatite E : une infection virale sous

14 | La Lettre de l’Infectiologue • Tome XXV - n° 1 - janvier-février 2010
MISE AU POINT
Hépatite E : une infection
virale sous-estimée
dans les pays industrialisés
Hepatitis E: an underestimated viral infection
in industrialized countries
F. Legrand-Abravanel*, **, C. Garrouste*, **, ***, J.M. Mansuy**, N. Kamar***, J.M. Peron****,
L. Rostaing*, ***, J. Izopet*, **
* INSERM, U563, centre de physio-
pathologie de Toulouse-Purpan,
Toulouse.
** Laboratoire de virologie, insti-
tut fédératif de biologie de Purpan,
hôpital Purpan, CHU de Toulouse.
*** Département de néphrologie,
dialyse et transplantation multiorgane,
hôpital Rangueil, CHU de Toulouse.
**** Département de gastro-enté-
rologie, hôpital Purpan, CHU de
Toulouse.
L
e virus de l’hépatite E (VHE) responsable d’hé-
patite à transmission entérique représente un
problème majeur de santé publique dans les
pays en développement ayant de faibles infras-
tructures sanitaires. Dans les pays industrialisés,
les infections avec le VHE étaient traditionnelle-
ment associées à une notion de voyage dans les
pays tropicaux où le virus est endémique. Toutefois,
de nombreux cas d’hépatites E acquises localement
ont été rapportés en Europe, au Japon et aux États-
Unis. Le VHE constitue donc un agent pathogène
émergent dans les pays industrialisés, ce qui justifie
une stratégie diagnostique adéquate (1).
Le virus de l’hépatite E
Le virus a été identifié en 1983, mais son génome n’a
été caractérisé qu’en 1991. Le VHE est un virus non
enveloppé, à ARN simple brin d’environ 7,2 kilobases.
En 2002, il a été classé dans le genre Hepevirus, au
sein de la famille des Hepeviridae, dont il est le seul
représentant. Quatre génotypes différents, ainsi que
de nombreux sous-types, ont été décrits chez les
mammifères (figure 1). Des souches aviaires pour-
raient constituer un nouveau genre. Ces génotypes
du VHE diffèrent selon leur répartition géographique
et leur spectre d’hôte (2). Les génotypes 1 et 2 sont
strictement humains et endémiques dans les pays
tropicaux d’Afrique, d’Asie et d’Amérique centrale. Le
génotype 3 a été identifié lors d’infections humaines
dans les pays industrialisés mais également chez le
porc, le sanglier et le cerf dans de nombreuses régions
du globe. Le génotype 4, retrouvé chez l’homme et
le porc, est présent uniquement en Asie. La proximité
génétique des souches humaines et porcines est très
élevée pour un même génotype (jusqu’à 94 % d’homo-
logie en nucléotides et 98 % en acides aminés) [2-4].
En France, le génotype 3f est prédominant mais les
génotypes 3c, 3e et 3b ont également été identifiés (3).
Épidémiologie et source
de contamination
Le principal mode de transmission du VHE est fécal-
oral. Toutefois, des transmissions mère-enfant
ainsi que des contaminations par transfusion ont
été rapportées. La majorité des épidémies dans les
pays en développement sont liées à des mesures
d’hygiène collectives insuffisantes (5). Ces épidémies
sont liées à une transmission hydrique et sont plus
importantes lors de la saison des pluies. D’après les
études publiées, le VHE est responsable de plus de
50 % des cas d’hépatites aiguës en Inde, et de 15 à
25 % des cas en Afrique et au Proche-Orient (4).
La prévalence des IgG est donc très élevée dans les
pays du Sud, tels que l’Égypte (de l’ordre de 70 %).
Cependant, de façon surprenante, les études de séro-
prévalence conduites dans les pays industrialisés
ont retrouvé des valeurs très élevées dans certaines
régions : 20,6 % au Danemark (6), 18 % aux États-
Unis (7), et 16 % au Royaume-Uni (8). En France, la
séroprévalence était de 3,2 % dans la région pari-
sienne et la région nantaise (9), mais de 16,6 %
dans le Sud-Ouest (10). L’incidence des infections

Tchad-Hm
Népal-Hm
Égypte-Hm
Maroc-Hm Birmanie-Hm
Inde-Hm
Chine-Hm
Indonésie-Hm
Japon-porc
Japon-Hm
Taïwan-porc
Chine-Hm
Royaume-Uni-porc
Pays-Bas-porc
Espagne-Hm
France-Hm
États-Unis-Hm
États-Unis-porc
Japon-cerf
Mexique-Hm
1
2
34
Figure 1. Arbre phylogénétique, basé sur la séquence d’un fragment de 348 nucléotides du gène de la capside du
VHE, représentant les 4 génotypes du virus. Les génotypes 1 et 2 n’infectent que les humains (Hm), alors que les
génotypes 3 et 4 ont été retrouvés chez différents mammifères.
La Lettre de l’Infectiologue • Tome XXV - n° 1 - janvier-février 2010 | 15
Résumé
Le virus de l’hépatite E (VEH) est endémique dans de nombreux pays en développement. Dans les pays
industrialisés, l’infection était considérée comme rare et confinée aux patients revenant de voyage d’une
zone d’endémie, mais des hépatites E autochtones sont en fait identifiées de plus en plus souvent. L’in-
fection est de mauvais pronostic chez un patient présentant une hépatopathie sous-jacente ou durant
la grossesse. Elle peut évoluer en hépatite chronique chez les sujets immunodéprimés. Dans les pays
industrialisés, les infections pourraient avoir une origine zoonotique avec le porc et le sanglier comme
réservoirs. En conséquence, même s’ils n’ont pas voyagé récemment, les patients présentant une hépatite
inexpliquée doivent bénéficier d’un dépistage du VEH fondé sur la mise en évidence des IgM et de l’ARN
viral dans le sang et les selles.
Mots-clés
Hépatite E
Pays industrialisé
Zoonose
Infection émergente
Highlights
Hepatitis E is endemic in
many developing countries.
In industrialized countries, it
was considered as rare, and
largely confined to travellers
returning from endemic areas.
Autochthonous hepatitis E is
now more and more frequently
identified in industrialized
countries. The infection has a
poorer prognosis in the context
of pre-existing chronic liver
disease or during pregnancy. It
might become chronic in immu-
nocompromised patients. The
infection might be a zoonosis
with swine and wild boar as
reservoirs. Patients with unex-
plained hepatitis should be
tested for IgM antibodies and
HEV RNA in sera and stools
whatever their travel history.
Keywords
Hepatitis E
Industrialized countries
Zoonosis
Emerging infection
autochtones par le VHE semble plus importante
que celle du virus de l’hépatite A au Royaume-Uni
ou en France (11, 12).
La source de contamination dans les pays industria-
lisés reste incertaine, mais l’origine zoonotique des
infections semble la plus probable. De nombreux
arguments vont dans ce sens. Le porc a été iden-
tifié comme un réservoir majeur du VHE dans de
nombreux pays. À l’âge de 6 mois, la majorité des
porcs d’élevage sont infectés (2). L’homologie
génétique entre les souches de VHE humaines et
les souches porcines est un élément important en
faveur de l’origine zoonotique du virus (1-3, 13). De
plus, le franchissement de la barrière d’espèce a été
démontré expérimentalement. Le chimpanzé ou le
singe rhésus peuvent être infectés par des virus d’ori-
gine humaine ou porcine. Les primates développent
alors une infection similaire à l’infection de l’homme
avec des lésions hépatiques et une séroconversion
6 semaines après l’inoculation (14). Des modes de
contamination anecdotiques ont été rapportés : un
chirurgien s’exerçant sur les cochons (15) et un petit
cochon domestique infectant son propriétaire (16).
Des contaminations intrafamiliales sont également

16 | La Lettre de l’Infectiologue • Tome XXV - n° 1 - janvier-février 2010
L’hépatite E: une infection virale sous-estimée
dans les pays industrialisés
MISE AU POINT
possibles (17). De même, la séroprévalence des
sujets exposés directement au réservoir animal en
raison d’une activité professionnelle (agriculteurs ou
vétérinaires s’occupant d’élevages porcins) [6, 7] ou
d’une activité de loisir (chasseurs dans le Sud de la
France) [10] est également plus élevée que dans la
population générale. La consommation d’aliments
contaminés insuffisamment cuits pourrait être la
source des infections dans les pays industrialisés.
Le virus a été retrouvé dans des produits d’origine
porcine aux États-Unis, au Japon et en France. La
consommation de viande de cerf ou de sanglier insuf-
fisamment cuite a été la source de contaminations
au Japon (18, 19). Une étude réalisée chez 45 patients
infectés par le VHE en Allemagne a montré que la
consommation d’abats ou de viande de sanglier
était un facteur indépendant associé à la contami-
nation (20). Une exposition à un environnement
souillé pourrait également être en cause : le virus
a été détecté dans des eaux usées en France et en
Espagne (21), ainsi que dans des cours d’eau, comme
la Meuse aux Pays-Bas (13).
Manifestations cliniques
Les formes cliniques peuvent varier des formes
asymptomatiques jusqu’aux hépatites fulminantes.
La période d’incubation est en moyenne de 40 jours
(extrêmes : 15-60 jours) [2]. Les formes asymptoma-
tiques sont probablement très fréquentes. Le tableau
classique est similaire à celui des autres hépatites
virales aiguës, associant asthénie, hépatomégalie
et ictère cutanéo-muqueux, mais comporte égale-
ment des manifestations moins classiques, telles
que des atteintes articulaires ou une thrombopénie
(tableau) [22]. L’ictère est présent dans 68 % des
cas. À l’inverse des infections survenant dans les pays
tropicaux, les infections autochtones diagnostiquées
dans les pays industrialisés surviennent plus souvent
chez des hommes d’âge mûr (1, 22). La majorité
des infections sont spontanément résolutives sans
complications. Toutefois, les formes fulminantes,
estimées à 1 à 4 % des hépatites aiguës, sont plus
fréquentes que pour l’hépatite A. Le taux de morta-
lité est très élevé (20 %) chez la femme enceinte,
pour des raisons encore inexpliquées. La sévérité de
l’infection chez le fœtus semble liée à la sévérité de
l’infection chez la mère. Des formes fulminantes ont
également été rapportées chez des sujets présentant
une hépatopathie sous-jacente (23).
Plus récemment, des formes chroniques ont été décrites
chez les sujets soumis à un traitement immunosup-
presseur dans le cadre d’une chimiothérapie anticancé-
reuse (24-26) ou d’une transplantation (27-29). Elles se
caractérisent par la persistance de la réplication du virus
pendant plus de 6 mois pouvant être détectée dans le
sang ou les selles. Cette persistance s’accompagne de
lésions hépatiques de fibrose sur la biopsie hépatique
avec, dans certains cas, le développement rapide d’une
cirrhose après 2 à 3 ans d’évolution (30, 31). Dans une
série de 14 cas d’hépatite E survenant chez des trans-
plantés hépatiques et rénaux, 8 patients (57 %) ont
présenté une infection chronique caractérisée par la
persistance du génome viral dans le sang, une éléva-
tion des aminotransférases et des lésions d’hépatite
chronique (28). Le développement d’une infection
chronique était associé à une contamination survenant
peu de temps après la transplantation et à des valeurs
faibles de lymphocytes T CD3 et CD4. L’évolution vers
la chronicité pourrait être liée à une faible réponse
des lymphocytes T CD4 anti-VHE responsable d’une
faible réponse des lymphocytes T CD8 qui assurent
habituellement l’élimination des hépatocytes infectés.
En conséquence, la modulation du traitement immu-
nosuppresseur pourrait favoriser l’élimination du virus.
Diagnostic virologique
de l’infection
Des outils sérologiques et moléculaires permettent la
mise en évidence des différents marqueurs (figure 2).
La réplication virale est préférentiellement hépatocy-
taire. L’excrétion du virus dans les selles débute environ
2 semaines après le contage et peut persister pendant
plus de 4 semaines. La virémie précède la cytolyse
hépatique et l’ictère. Le virus est présent dans le plasma
et dans les selles au début des signes cliniques. L’excré-
Tableau. Fréquence des symptômes retrouvés chez 62 patients avec une primo-infection par le
VHE (22).
Symptômes Fréquence (%)
Ictère 67,7
Asthénie 40,3
Fièvre 27,4
Arthralgies, myalgies 21
Douleurs abdominales 11,3
Céphalées 9,7
Nausées 9,7
Anorexie 8,1
Amaigrissement 6,5
Diarrhée 4,8
Purpura 3,2
Références
bibliographiques
1. Dalton HR, Bendall R, Ijaz S, Banks
M. Hepatitis E: an emerging infec-
tion in developed countries. Lancet
Infect Dis 2008;8:698-709.
2. Meng XJ. Hepatitis E virus: animal
reservoirs and zoonotic risk. Vet
Microbiol 2009 Mar 20 [Epub
ahead of print].
3. Legrand-Abravanel F, Mansuy
JM, Dubois M et al. Hepatitis E virus
genotype 3 diversity, France. Emerg
Infect Dis 2009;15:110-4.
4. Purcell RH, Emerson SU. Hepa-
titis E: an emerging awareness
of an old disease. J Hepatol
2008;48:494-503.
5. Balayan MS. Epidemiology of
hepatitis E virus infection. J Viral
Hepat 1997;4:155-65.
6. Christensen PB, Engle RE, Hjort C
et al. Time trend of the prevalence
of hepatitis E antibodies among
farmers and blood donors: a poten-
tial zoonosis in Denmark. Clin Infect
Dis 2008;47:1026-31.
7. Meng XJ, Wiseman B, Elvinger
F et al. Prevalence of antibodies
to hepatitis E virus in veterinarians
working with swine and in normal
blood donors in the United States
and other countries. J Clin Microbiol
2002;40:117-22.
8. Dalton HR, Stableforth W, Thurai-
rajah P et al. Autochthonous hepa-
titis E in Southwest England: natural
history, complications and seasonal
variation, and hepatitis E virus IgG
seroprevalence in blood donors, the
elderly and patients with chronic
liver disease. Eur J Gastroenterol
Hepatol 2008; 20:784-90.
9. Boutrouille A, Bakkali-Kassimi L,
Cruciere C, Pavio N. Prevalence of
anti-hepatitis E virus antibodies in
French blood donors. J Clin Micro-
biol 2007;45:2009-10.

Symptômes
Virus dans les selles
Virémie
IgG
IgM
Transaminases
Contage
2010 30 40 50 60 jours 34 mois
après infection
Figure 2. Représentation schématique de l’évolution des marqueurs du VHE lors d’une
infection aiguë.
La Lettre de l’Infectiologue • Tome XXV - n° 1 - janvier-février 2010 | 17
MISE AU POINT
tion du virus dans les selles dure plus longtemps que la
virémie. La recherche des IgM, qui persistent générale-
ment 3 mois, est essentielle au moment de la cytolyse
hépatique. Les IgG augmentent peu de temps après
l’apparition des IgM et peuvent persister des années.
Différentes trousses sérologiques sont disponibles en
France afin de rechercher les IgM, mais la présence de
ce marqueur, lors de la phase aiguë, n’est observée que
dans 82 à 90 % des cas (32).
La recherche de l’ARN viral par des techniques de
biologie moléculaire est donc un complément néces-
saire pour poser le diagnostic. La recherche de l’ARN
viral dans les selles permet d’identifier 15 % d’infections
de plus qu’une détection génomique réalisée unique-
ment dans le sang. Chez les patients immunodéprimés,
la persistance d’une virémie pendant plus de 6 mois
définit le passage à la chronicité.
Le diagnostic d’hépatite virale E était classiquement
orienté par la négativité des marqueurs A, B et C, dans le
contexte d’un séjour datant de moins de 2 mois en pays
d’endémie. Il doit maintenant être évoqué en France
devant toute hépatite aiguë d’origine inexpliquée.
Traitement et prévention
Le traitement de l’hépatite E est uniquement sympto-
matique. Les formes fulminantes nécessitent une hospi-
talisation en milieu spécialisé en vue de l’indication
éventuelle d’une transplantation. En zone d’endémie,
la prévention consiste principalement à contrôler les
eaux de boisson. La prévention des cas autochtones
nécessite avant tout de poursuivre les études visant
à une meilleure compréhension de l’épidémiologie
de cette infection. Le rôle du réservoir animal et de
l’environnement dans le maintien de la circulation du
virus devra être précisé. Ceci pourrait conduire à la
mise en œuvre de précautions alimentaires en matière
de cuisson des aliments d’origine porcine. Quant à la
disponibilité d’un vaccin, des essais cliniques de phase 2
ont été conduits en 2005 et 2006 chez les militaires
népalais. Bien que les résultats d’immunogénicité
soient encourageants, on ne sait pas quand un vaccin
pourrait être disponible.
Conclusion
Le VHE représente un problème de santé publique
émergent dans les pays industrialisés. Son impor-
tance est encore sous-estimée, car la recherche du
virus n’est pas actuellement systématique dans une
situation d’hépatite aiguë. L’identification de formes
graves chez les patients présentant une hépatopathie
sous-jacente et chez les patients immunodéprimés
incite à préciser les modes de contamination dans les
pays industrialisés afin de mieux définir les stratégies
préventives chez ces sujets susceptibles de développer
des formes graves. ■
14. Meng XJ, Halbur PG, Shapiro MS et al. Genetic and experi-
mental evidence for cross-species infection by swine hepatitis
E virus. J Virol 1998;72:9714-21.
15. Colson P, Kaba M, Bernit E, Motte A, Tamalet C. Hepatitis E
associated with surgical training on pigs. Lancet 2007; 370:935.
16. Renou C, Cadranel JF, Bourliere M et al. Possible zoonotic
transmission of hepatitis E from pet pig to its owner. Emerg Infect
Dis 2007;13:1094-6.
17. Ducancelle A, Payan C, Nicand E, Le Guillou H, Cales P,
Lunel-Fabiani F. Intrafamilial hepatitis E in France. J Clin Virol
2007;39:51-3.
18. Li TC, Chijiwa K, Sera N et al. Hepatitis E virus transmission
from wild boar meat. Emerg Infect Dis 2005; 11:1958-60.
19. Tei S, Kitajima N, Takahashi K, Mishiro S. Zoonotic trans-
mission of hepatitis E virus from deer to human beings. Lancet
2003;362:371-3.
20. Wichmann O, Schimanski S, Koch J et al. Phylogenetic and
case-control study on hepatitis E virus infection in Germany. J
Infect Dis 2008;198:1732-41.
21. Clemente-Casares P, Pina S, Buti M et al. Hepatitis E virus
epidemiology in industrialized countries. Emerg Infect Dis
2003;9:448-54.
22. Mansuy JM, Abravanel F, Miedouge M et al. Acute hepa-
titis E in South-West France over a 5-year period. J Clin Virol
2009;44:74-7.
23. Peron JM, Bureau C, Poirson H et al. Fulminant liver failure
from acute autochthonous hepatitis E in France: description of
seven patients with acute hepatitis E and encephalopathy. J Viral
Hepat 2007;14:298-303.
24. Peron JM, Mansuy JM, Recher C et al. Prolonged hepatitis
E in an immunocompromised patient. J Gastroenterol Hepatol
2006;21:1223-4.
25. Ollier L, Tieulie N, Sanderson F et al. Chronic hepatitis
after hepatitis E virus infection in a patient with non-Hodgkin
lymphoma taking rituximab. Ann Intern Med 2009; 150:430-1.
26. Tamura A, Shimizu YK, Tanaka T et al. Persistent infection of
hepatitis E virus transmitted by blood transfusion in a patient with
T-cell lymphoma. Hepatol Res 2007; 37:113-20.
27. Haagsma EB, van den Berg AP, Porte RJ et al. Chronic hepa-
titis E virus infection in liver transplant recipients. Liver Transpl
2008;14:547-53.
28. Kamar N, Selves J, Mansuy JM et al. Hepatitis E virus and
chronic hepatitis in organ-transplant recipients. N Engl J Med
2008;358:811-7.
29. Gerolami R, Moal V, Picard C, Colson P. Hepatitis E virus as
an emerging cause of chronic liver disease in organ transplant
recipients. J Hepatol 2009;50:622-4.
30. Gerolami R, Moal V & Colson P. Chronic hepatitis E
with cirrhosis in a kidney-transplant recipient. N Engl J Med
2008;358:859-60.
31. Kamar N, Mansuy JM, Cointault O et al. Hepatitis E virus-
related cirrhosis in kidney- and kidney-pancreas-transplant
recipients. Am J Transplant 2008;8:1744-8.
32. Legrand-Abravanel F, Thevenet I, Mansuy JM et al. Good
performance of immunoglobulin M assays in diagnosing
genotype 3 hepatitis E virus infections. Clin Vaccine Immunol
2009;16(5):772-4.
10. Mansuy JM, Legrand-Abravanel F,
Calot JP et al. High prevalence of anti-
hepatitis E virus antibodies in blood
donors from South West France. J
Med Virol 2008;80:289-93.
11. Dalton HR, Stableforth W,
Hazeldine S et al. Autochthonous
hepatitis E in Southwest England:
a comparison with hepatitis A.
Eur J Clin Microbiol Infect Dis
2008;27:579-85.
12. Peron JM, Mansuy JM, Poirson H
et al. Hepatitis E is an autochthonous
disease in industrialized countries.
Analysis of 23 patients in South-
West France over a 13-month
period and comparison with
hepatitis A. Gastroenterol Clin Biol
2006;30:757-62.
13. Rutjes SA, Lodder WJ, Lodder-
Verschoor F et al. Sources of
hepatitis E virus genotype 3 in The
Netherlands. Emerg Infect Dis
2009;15:381-7.
1
/
4
100%