Determination spectrophotométrique dans le domaine UV de l

Pharmacie 1ere année 2002-2003
Travaux pratiques de chimie analytique
Spectrophotométrie
Colorimétrie
INTRODUCTION ...................................................................................................................... 1
RAPPELS THEORIQUES ........................................................................................................... 2
DEFINITIONS .......................................................................................................................... 3
LOI DE BEER-LAMBERT ......................................................................................................... 5
METHODES D’ANALYSE SPECTROPHOTOMETRIQUE................................................................ 6
Méthode de l’étalon externe ............................................................................................. 6
Méthode de l’étalon interne.............................................................................................. 6
Méthode de la droite d’étalonnage................................................................................... 7
PARTIE PRATIQUE.................................................................................................................. 8
Dosage spectrophotométrique du Fe2+ par l’ortho-
phénathroline......................................................................................................... 8
Procédure ...................................................................................................................... 8
Rapport .........................................................................................................................9
Détermination de l’acide phosphorique dans le coca-cola10
Préparation des solutions............................................................................................ 10
Dosage colorimétrique................................................................................................ 11
Rapport ....................................................................................................................... 11
Introduction
Parmi les nombreuses méthodes instrumentales utilisées pour déterminer la concentration
d’une espèce chimique en solution, les méthodes les plus courantes sont celles basées sur la
mesure de l’intensité d’absorption ou d’émission (spectrophotométrie) d’un rayonnement
électromagnétique par les espèces à doser. Les rayonnements les plus souvent utilisés sont
l’ultraviolet (UV), la lumière visible et l’infrarouge (IR). Le domaine du visible et de l’UV a
été abondamment étudié et ce depuis longtemps. Mais s’il est indispensable pour une
approche expérimentale de la nature de la liaison chimique, il est pauvre en information
structurale. Son emploi est de plus en plus réservé à l’analyse quantitative via la loi de Beer-
Lambert.
1

Pharmacie 1ere année 2002-2003
Travaux pratiques de chimie analytique
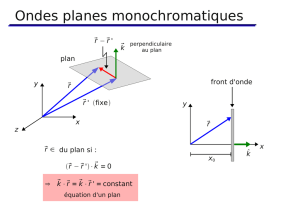
Domaines spectraux des ondes électromagnétiques
Les longueurs d’ondes des couleurs du spectre de la lumière visible sont indiquées dans le
schéma suivant :
Rouge
Vert
Jaune
Orange Violet
Bleu
400-450 nm
450-500 nm
500-550 nm
550-600 nm
600-650 nm
650-750 nm
Lorsqu’un composé émet, par exemple, une lumière dont la longueur d’onde vaut 425
nanomètre (nm), la couleur observée, violette, est la couleur émise. Pour un composé qui
absorbe la lumière à cette longueur d’onde, la coloration résultante est celle obtenue par
addition de toutes les couleurs sauf le violet. L’œil perçoit cette coloration comme étant la
complémentaire (c’est-à-dire diamétralement opposée : jaune dans ce cas). Ainsi l’ion
chromate, CrO42- qui absorbe dans le violet, apparaît comme jaune.
Rappels théoriques
Les méthodes spectroscopiques sont des techniques basées sur l’interaction entre un photon et
un atome ou plus généralement une molécule. L’énergie du photon est absorbée par une
molécule (ou un atome) se trouvant dans son état fondamental (niveau d’énergie le plus bas)
et se retrouve alors dans un état excité d’énergie plus élevée. Selon l’énergie du photon,
plusieurs types de processus d’excitation peuvent être engagés. La mécanique quantique nous
a appris les sauts d’énergies (passage d’un état quantique à un autre) sont quantifiés.
Etat fondamental
Etat excité
νν
h
h
Absorption Emission
∆E
Schéma énergétique des phénomènes d’absorption électronique et d’émission de radiation
électromagnétique par la matière.
2

Pharmacie 1ere année 2002-2003
Travaux pratiques de chimie analytique
La différence d’énergie entre les deux états,
∆
E, est liée à la fréquence du rayonnement par la
relation suivante : ∆Eh=
ν
où h est la constante de Plank (6.626·10-34 J·s) et
ν
est la fréquence de la radiation. Celle-ci est
reliée à la longueur d’onde
λ
et au nombre d’onde par la relation suivante :
σλ
ν
==
1
c
où c est la célérité de la lumière (3·108 m·s-1). Selon le domaine considéré, on utilise par
commodité des unités différentes pour exprimer le rayonnement électromagnétique. En UV
on indique la longueur d’onde en nm alors qu’en IR on utilisera le nombre d’onde en cm-1.
L’absorption de photons se traduit par des transitions d’électrons engagés dans les orbitales
moléculaires situées à la frontière entre les derniers niveaux occupés de l’état fondamental et
les premiers niveaux non occupés des états excités (transitions vibroniques). Chaque
transition est caractérisée à la fois par sa longueur d’onde (
λ
) et par son coefficient
d’absorption molaire (
ε
).
Il existe plusieurs types de transitions, désignés par la nature (σ, π, d, n, σ*, π*) des orbitales
moléculaires engagées dans le processus d’émission. Les principales transitions électroniques
sont les suivantes :
- Transition σ→σ* (UV lointain)
- Transition n→σ* (UV)
- Transition n→π* (UV)
- Transition π→π* (UV proche)
- Transition d→d. (Visible)
Les transitions d-d sont responsables de la coloration de nombreux complexes.
Après l’étape d’absorption, l’énergie captée peut être restituée soit par un processus non
radiatif (chaleur), soit par une émission de photons (fluorescence et phosphorescence).
Définitions
On définit comme groupement chromophore, la fonction chimique ou la partie de la
molécule qui est responsable d’une absorption caractéristique. Pour une série de composés
possédant le même chromophore, la position et l’intensité des bandes d’absorption restent
sensiblement constantes, sauf s’il y a accumulation de plusieurs chromophores à proximité les
uns des autres. Lorsque les chromophores sont isolés, c’est-à-dire séparés par au moins deux
liaisons simples, on observe uniquement la superposition des effets individuels. La polarité du
solvant peut modifier la position, l’intensité et la forme des bandes d’absorption des
composés en solution. Ces effets sont définis comme suit :
- Effet hypsochrome : Diminution de la longueur d’onde.
- Effet bathochrome : Augmentation de la longueur d’onde.
- Effet hyperchrome : Augmentation du coefficient d’absorption molaire.
- Effet hypochrome : Diminution du coefficient d’absorption molaire.
Par exemple, pour la transition n→σ* du carbonyle des cétones, l’utilisation d’un solvant
polaire provoque un effet hypsochrome. Avant absorption, la polarisation de la liaison C-O
sera d’autant plus stabilisé par la présence d’un solvant polaire. Après absorption, quand l’état
3

Pharmacie 1ere année 2002-2003
Travaux pratiques de chimie analytique
excité est atteint, la cage de solvant qui entoure le carbonyle n’a pas eu le temps de se
réorienter pour stabiliser la situation.
4

Pharmacie 1ere année 2002-2003
Travaux pratiques de chimie analytique
Quelques exemples de bandes d’absorption dans l’UV caractéristiques de chromophores:
Chromophore
λmax
(nm)
εmax
NH2 (amine) 195 3000
NO2 (nitro) 210 3000
N=O (nitroso) 300 100
C=O (carbonyle) 275 20
Loi de Beer-Lambert
Le principe de l’utilisation de la spectrophotométrie pour l’analyse quantitative est basé sur le
fait que l’intensité d’absorption (ou d’émission) est fonction de la concentration de la
particule qui absorbe (ou qui émet) de la lumière.
I0I
l
L um ière incidente L um ière transm ise
Chem in optique
Lorsque d’une lumière monochromatique d’intensité Io traverse un milieu homogène,
l’intensité de la lumière émergente I décroît selon une fonction exponentielle lorsque
l’épaisseur l du milieu absorbant augmente. Si on étudie principalement des solutions, la loi
de Beer fait intervenir les concentrations et s’exprime sous la forme suivante :
log 0
I
Icl D==
ε
où
ε
est le coefficient d’extinction molaire (l·mol-1·cm-1), c est la concentration de la solution
(mol-1·l), l est le chemin optique (cm). Le rapport
I
I
o
est appelé la transmission (aussi
appelée « transmittance » et notée T), celle-ci est reliée à la densité optique, D, (aussi
appelée « absorbance ») par la relation :
DT
=log 1
Un spectre d’absorption (ou d’émission) présente la variation de l’absorption (ou d’émission)
en fonction de la longueur d’onde.
5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%