Chap1 Le modèle de l`atome.

Chap1 Le modèle de l’atome.
Objectifs:
Connaître les constituants de l’atome, (noyau, électrons)
Connaître la structure interne d’un noyau atomique (protons, neutrons)
Mettre en relation le nombre de protons du noyau de l’atome avec le tableau périodique (élément chimique)
I. Les dimensions de l’atome.
Activité : animation htwins. htwins
Morceaux de
sucre
Fourmis
Acariens
Cellules
Nano-
voiture
Molécules
d’ADN
Atomes
Noyaux
d’atomes
10-2 m :
10-3 m :
10-4 m :
10-5 m :
10-8 m :
10-9 m
10-10 m
10-15 m
centimètre
(1 cm)
millimètre
(1 mm)
dixième de
millimètre
(0,1 mm)
dizaine de
micromètre
(1 µm)
dix
nanomètres
(10 nm)
milliardième
de mètre ou
nanomètre
(1 nm)
dixième de
nanomètre
(0,1 nm)
millionième de
milliardième de
mètre ou
femtomètre
(1 fm)
http://lpsc.in2p3.fr/comm-corinne/Echelle_grandeurs/Lechelle_des_grandeurs.html
Au niveau microscopique, la matière est constituée d’un nombre limité d’atomes qui sont répertoriés dans
le tableau périodique des éléments (92 dans la nature)
A RETENIR :
L’atome est constitué d’un noyau autour duquel tournent des électrons
La taille d’un atome est de l’ordre de 0.1 nanomètre (10-10m), celle du noyau
est 100 000 fois plus petite soit 10-15m. Le noyau est donc principalement
entouré de vide dans lequel se déplacent les électrons à l’image des planètes
qui se déplacent autour du soleil.
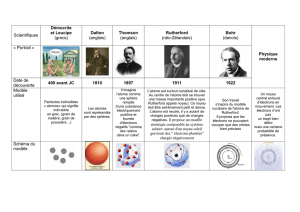
Activité : L’histoire du modèle de l’atome.

Portrait de Leucippe
Buste d'Aristote(
John Dalton
Joseph John Thomson
Ernest Rutherford
Niels Bohr
Erwin Schrödinger
Leucippe et Démocrite
deux philosophes grecs,
pensent que la matière
est constituée de grains
indivisibles (atomos, en
grec), les atomes. Pour
eux les atomes sont tous
pleins, mais ne sont pas
tous semblables : Ils sont
ronds ou crochus, lisses
ou rugueux
Le philosophe grec,
Aristote rejette la théorie
de l'atome et reprend
l’idée des quatre éléments
émise par Empédocle.
Dalton, physicien
britannique suppose
l’existence des atomes et
suppose qu’il en existe
plusieurs types, qui
permettent d’expliquer les
propriétés de la matière ; Il
les représente par une
sphère ronde, comme une
boule de billard
7 ans après la découverte
de l’existence des électrons
en 1895 par le Britannique
Crookes, Thomson ,
physicien britannique
propose un modèle de
l’atome appelé le “ pudding
aux électrons ” : L’atome
est une boule
électriquement neutre
remplie d’une substance
chargée positivement et
d’électrons chargés
négativement
7 ans après Thomson,
Rutherford, physicien
britannique , propose un
modèle planétaire de
l’atome ; il compare
l’atome au système solaire
: l’atome est constitué d’un
noyau, autour duquel
gravitent les électrons. Le
noyau est environ 105 fois
plus petit que l’atome,
donc l’atome est
essentiellement constitué
de vide.
4 ans après le modèle
planétaire émis par
Rutherford,Bohr propose
un nouveau modèle : Les
électrons tournent autour
de l’atome selon des
orbites de rayon défini, pas
tous identique, et pas
toutes contenues dans le
même plan.
Les physiciens du 20e siècle
comme Erwin Schrödinger
ont admis que la notion
d’orbite n’a plus de sens
pour un électron dans un
atome : les électrons
tournent autour de l’atome
de façon aléatoire et
désordonnée : on parle “
de probabilité de trouver
l’électron à une distance
donné du noyau
Les quatre éléments.
+
-
Electron négatif
Orbites bien définie
+

A RETENIR :
Dans un atome, il y a autant de particules positives que de particules négatives.
L’atome est donc électriquement neutre.
Exercices niveau basique : 2-3 p46 (correction
livre p 251)
Exercices niveau confirmé :
12 p47 :
1. 10 atomes accolés correspondent à 2,3 cm.
Cela donne pour un atome un diamètre de 2,3 mm.
L’échelle donne 3,8 cm pour 5 nm. Par proportionnalité,
on trouve pour l’atome un diamètre de l’ordre de
0,3 nm, ce qui correspond à un ordre de grandeur du
1/10 de nanomètre. 2. Agrandissement de la
photographie
: 3,8 × 10–2 / 5 × 10–9 = 7 600 000.
19p48
a. 3. ; b. 5. ; c. 1. ; d. 2. ; e. 4.
Activité vidéo : atomes et isotopes.
A RETENIR :
Le noyau contient des protons et des neutrons
Le proton porte une charge élémentaire positive, l’électron une charge
élémentaire négative, le neutron une charge neutre.
La quasi-totalité de la masse de l’atome est contenue dans son noyau.
Activité: Les réactions dans les centrales nucléaires.
Exercices niveau expert :13p47
1. La distance demandée correspond au rayon du ballon multiplié par 100 000, soit 11 km.
2. Cette distance correspond à 110 longueurs de terrain de football.
Activité « construire un atome » phet
Nom
Symbole
Nombre
de protons
Nombre
de
neutrons
Nombre
d’électrons
Modèle (dessin)
Hydrogène
H
1
0
1
Helium
He
2
2
2
Carbone
C
6
6
6

Oxygène
O
8
8
8
A RETENIR :
Un atome est électriquement neutre car il contient
autant de proton (+) que d’électron (-)
Bilan :
Exercices 14p47
1. m(noyau)/m(électron) = 1,67 × 10–27 / 9,1 × 10–
31 = 1 800 environ.
2. Cela confirme que la masse est essentiellement
concentrée dans le noyau.
22p48
1. Fer : Fe ; cuivre : Cu ; aluminium : Al ; argent :
Ag ; or : Au.
2. Fe : 26 ; Cu : 29 ; Al : 13 ; Ag : 47 ; Au :
79.
3. Le plus riche : Au, le plus pauvre : Al.
Exercices niveau basique: 4-5-6p46
1
/
4
100%