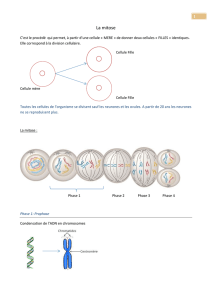
Transgenèse par modification des spermatozoïdes

CREATION D’ANIMAUX
TRANSGENIQUES PAR
MODIFICATION DES
SPERMATOZOIDES
Yves Demulière
Lise Grout
Ludovic Simon

Création d’animaux transgéniques par
modification des spermatozoïdes
I. Transgenèse par modification des spermatozoïdes :
1. Avantages par rapport aux autres méthodes
2. Incubation avec de l’ADN
3. Electroporation
4. Décondensation du noyau
II. Transgenèse par modification des précurseurs :
1. Transfection et recombinaison homologue
2. Infection virale
III. Application au génie génétique :
1. Espoirs
2. Problèmes éthiques

I. Transgenèse par modification
des spermatozoïdes
1. Avantages par rapport aux
autres méthodes:

a. Présentation des autres méthodes
Microinjection d’ADN :
- introduction d'un gène ou plus d'un autre animal, d'espèce identique ou différente,
dans le pronucléus d'un ovocyte fécondé
- forte probabilité de ne pas s'intégrer dans un site de l'ADN hôte favorisant son
expression
Transfert de gènes à l'aide de cellules souches
embryonnaires :
- recombinaison homologue dans une culture in vitro de cellules ES, intégrées à un
embryon au stade blastocyte
- animal chimérique
- méthode knock-out
Transfert de gènes à l'aide de rétrovirus :
- vecteurs (en général un plasmide ou un virus), les rétrovirus présentant une facilité
à infecter les cellules hôtes
- chimères, l’ADN modifié devant être intégré aux cellules germinales pour que le
transgène puisse être transmis

b. Problèmes avec ces méthodes
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
1
/
16
100%