THERMODYNAMIQUE

1
Thermodynamique - PHS 2101
S
2 types de parois:
2 types de contacts
et d ’échange avec
l’extérieur.
Un système: S
D’une façon générale, on peut
avoir:
•échange de matière
•échange d énergie
•échange de volume
J.M. Lina

2
Thermodynamique - PHS 2101
Un système peut être composé de plusieurs sous-
systèmes en contact (échanges possibles).
L 'extérieur d ’un système est lui-même un système.
La nature des parois (qui peuvent être imaginaires)
entre les (sous-)systèmes définissent différents
types de systèmes:
Un système ouvert : il peut échanger avec l 'extérieur
de la masse, de l 'énergie. Exemple: un moteur, la
terre sans son atmosphère,...
J.M. Lina

3
Thermodynamique - PHS 2101
Un système fermé: ne peut échanger de matière
avec l’extérieur, mais peut échanger de l’énergie.
(la masse totale du système est constante).
Exemple: une masse gazeuse dans un récipient clos,
la terre avec son atmosphère,...
Un système adiabatique : peut échanger seulement
un certain type d 'énergie, du travail. Ce sont des
systèmes thermiquement isolés.
Un système isolé: aucun échange d énergie avec
l’extérieur. Exemple: une bouteille Thermos idéale.
J.M. Lina

4
Thermodynamique - PHS 2101
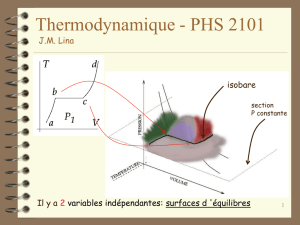
L état d ’un système thermodynamique :
Il s ’agit de décrire le système par un nombre minimal
de grandeurs (variables d 'état). D ’autres quantités
peuvent donner de l ’information sur le système: elles
s’expriment en fonction des variables d 'état, ce
sont des fonctions d 'état.
J.M. Lina

5
Thermodynamique - PHS 2101
•Le volume V du système, exprime en m3.
Pour les fluides, deux variables d 'état issues de
la mécanique:
•La pression P, exprimée en Pa (pascal):
C’est la force (N) qui s ’exerce perpendiculairement
à une surface, par unité de surface:
1 Pa = 1 N/m2
Autre unité courante: le bar (météo), 1 bar = 105Pa
1 atm = 1.013 bar
EX.1 et 2
J.M. Lina
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
1
/
15
100%