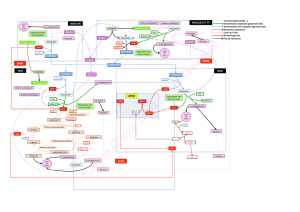
Résumé de la démarche expérimentale conduisant à la définition

Résumé de la démarche
expérimentale conduisant à la
définition des notions d’acide et
de base selon la théorie de
Bronstëd - Lowry
Auteur: Dupont P.
A.R. Quiévrain

Flacon A:
Solution
de chlorure
d’hydrogène 25%
Air
Flacon B:
Eau distillée
Réaction entre HCl(g) et H2O(l) 1
On verse une solution de
chlorure d ’hydrogène
concentrée dans un flacon
laveur (Flacon A) et de l’eau
distillée dans un autre (Flacon
B).
On connecte les deux flacons
avec un bout de tuyau.
On insuffle de l’air dans le
premier flacon laveur, l’air
chasse le HCl(g) vers le
deuxième flacon, il barbote
ainsi dans l’eau distillée.
HCl(g)
Air
HCl(g)

Réaction entre HCl(g) et H2O(l) 2
On verse l’eau qui a subi un
barbotage de HCl(g) dans deux
tubes à essais. Flacon compte-
gouttes contenant du
méthyl orange
Flacon compte-
gouttes contenant
une solution de
nitrate d ’argent
Virage du méthyl
orange:ce test
révèle la présence
de l’ion H3O+
Apparition d ’un
précipité blanc:
ce test révèle la
présence de l’ion
Cl-
Flacon B:
Eau distillée
ayant subi un
barbotage de
HCl(g)

Réaction entre HCl(g) et H2O(l) 3
Interprétation de l ’expérience réalisée:
La rencontre entre HCl(g) et H2O(l), se solde par une réaction chimique au
cours de laquelle il y a formation d ’ions. Cette réaction peut être traduite par
l’équation chimique suivante:
HCl(g) + H2O(l) H3O+(aq) + Cl-(aq)
Au cours de cette réaction , des entités H+ sont transférées d ’un donneur
vers un accepteur
HCl(g) + H2O(l) H3O+(aq) + Cl-(aq)
Perte d ’un H+
Gain d ’un H+

Flacon A:
Solution
d’ammoniaque 25%
Air
Flacon B:
Eau distillée
Réaction entre NH3(g) et H2O(l) 1
On verse une solution
d’ammoniaque concentrée dans
un flacon laveur (Flacon A) et
de l’eau distillée dans un autre
(Flacon B).
On connecte les deux flacons
avec un bout de tuyau.
On insuffle de l’air dans le
premier flacon laveur, l’air
chasse le NH3(g) vers le
deuxième flacon, il barbotte
ainsi dans l’eau distillée.
NH3(g)
Air
NH3(g)
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
1
/
17
100%





![[ ][][ MLn L M 10.3,6 ]) ([ ] [] [ = × = NH Ag NH Ag Kd](http://s1.studylibfr.com/store/data/002601672_1-57de8b0d2e37b3f5af3073b29cc142bc-300x300.png)