le diaporama


L’expérience
de Rutherford

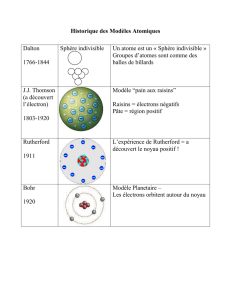
1. Le modèle de Thomson
En 1904, J. J. Thomson
imagine l’atome comme
un gâteau avec des
pépites de chocolat.
Le gâteau représente les parties chargées
positivement et les pépites représentent
les électrons chargés négativement.

2. L’expérience de Rutherford
En 1909, pour étudier la structure de l’atome,
E. Rutherford bombarde une fine feuille d’or
avec des particules alpha.

2. L’expérience de Rutherford
Rutherford place un détecteur tout autour
de la feuille d’or pour repérer la trajectoire
des particules.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%