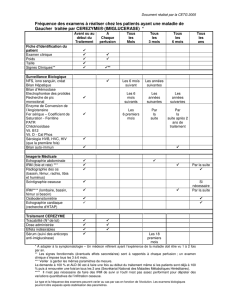
Document

Spécificités pédiatriques
Epilepsies
Nadine Girard
Hôpital Timone
Marseille France
2008

Epilepsies de l’enfant
•Pathologie fréquente
•Seuil épileptogène abaissé
•Formes bénignes communes
•Causes constitutionnelles, ou pathologies
périnatales
•Manifestations âge-dépendantes, donc évolutives
•Effets néfastes de l’épilepsie sur le
développement
•Effet des drogues sur le comportement

Techniques IRM
•Identiques à l’adulte
•Protocole minimum: T2 axial (coronal), Flair
et IR coronal, 3D-FT. Gadolinium au besoin
•Séquences complémentaires: T2*EG, T1 TM,
diffusion
•IRM doit être répétée
–Après chaque avancée technique
–D’autant que les explorations précédentes sont
considérées normales

Techniques IRM enfant
•Anesthésie chez le petit enfant ou non coopérant: IRM
n’est pas réellement non invasive
•Les paramètres des séquences IRM doivent être adaptées
à l’âge de l’enfant car la composition physicochimique
affecte le signal IRM: T2
•Entre la naissance et l’adolescence la composition
physicochimique du parenchyme change (maturation) avec
évolution des images en fonction de l’âge: les anomalies
IRM changent donc aussi avec le développement
•Signification des images FLAIR est incertaine avant 3-4
ans

•Signal paradoxal
sombre (comme en T1): nné
signal de l’eau (90%) est annulé
par l’impulsion d’inversion
•Alors que la substance blanche se
myélinise (perd son eau), signal plus conforme
à la pondération T2 à cet âge: hypersignal
maximum vers 4 mois
•Evolution T2 typique mais prolongée du signal,
diminution progressive,rejoint celui du cortex
vers 18 mois,
•Aspect mature à 4 ans.
14 mois 3 ans 4 ans
7 moisNouveau-né
FLAIR
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
1
/
23
100%