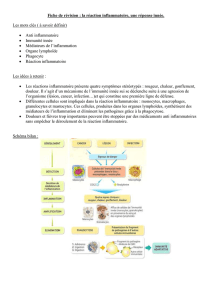
utilisation des marqueurs de l`inflammation en réanimation

Inflammation : nouvelles pistes 615
UTILISATION DES MARQUEURS DE
L’INFLAMMATION EN RÉANIMATION
O. Fourcade, S. Sacrista. Département d’Anesthésie-Réanimation, Hôpital Purpan, Place
du Dr Baylac, 31059 Toulouse Cedex, France.
INTRODUCTION
L’activation d’une réaction inflammatoire systémique est une conséquence com-
mune à de nombreuses pathologies rencontrées en réanimation. L’intensité du syndrome
de réponse inflammatoire systémique (SIRS) est un reflet de la gravité de l’affection
initiale, et participe à la survenue de complications telles que l’état de choc septique, le
syndrome de détresse respiratoire de l’adulte (SDRA), ou le syndrome de défaillance
multiviscérale. L’étude des mécanismes qui participent à la régulation de la réponse
inflammatoire a permis l’identification de nombreux médiateurs de l’inflammation. Le
dosage plasmatique de certains de ces marqueurs est réalisable en pratique clinique. Ils
aident à conforter un diagnostic de syndrome inflammatoire et permettent surtout le
«monitorage biologique» de la réponse inflammatoire. Le marqueur biologique est uti-
lisé comme un facteur pronostique et sa cinétique peut permettre d’apprécier l’efficacité
de la thérapeutique ou les conséquences de l’inflammation systémique. Son augmenta-
tion plasmatique n’est pas spécifique d’une étiologie, et n’est qu’un reflet de l’intensité
de la réponse inflammatoire. L’intérêt du dosage plasmatique d’un marqueur peut être
fonction de l’étiologie, des circonstances de survenue, et de l’existence de certaines
pathologies associées. En effet, la concentration et la cinétique plasmatique de ces
marqueurs sont également fonction des sites et des mécanismes de régulation de leur
synthèse, ou encore de leurs mécanismes d’élimination.
1. QUE SERAIT LE MARQUEUR INFLAMMATOIRE IDEAL?
Un marqueur idéal doit avoir une cinétique rapide. Sa concentration plasmatique
doit être un reflet fidèle de l’intensité de la réaction inflammatoire au moment du dosa-
ge. Ainsi la fiabilité du marqueur lors du diagnostic initial dépend du délai nécessaire à
son augmentation en cas de stimulation de l’inflammation. De même, sa cinétique plas-
matique n’est utile que si sa demi-vie plasmatique est suffisamment courte pour rendre
compte de l’efficacité de la thérapeutique instituée. La valeur pronostique d’un mar-
queur dépend directement de son aptitude à être un reflet de la réaction inflammatoire à
tout moment de l’évolution. Son dosage doit être précis et réalisable rapidement en
urgence. Il est par ailleurs important d’adapter la fréquence des dosages à la pharmaco-
cinétique du marqueur.

MAPAR 2001616
L’augmentation du marqueur doit dépendre exclusivement de la réaction inflamma-
toire, et doit être significative (> 25 %) par rapport à sa concentration plasmatique basale.
Un grand nombre de marqueurs remplissent cette condition si la situation de base est
représentée par le sujet sain. L’interprétation de l’augmentation plasmatique peut-être
plus délicate chez un patient qui présente une pathologie susceptible de modifier la
concentration normale. En effet, les marqueurs de l’inflammation sont caractérisés par
des variations qui sont indépendantes de l’étiologie du syndrome inflammatoire, or il
est fréquent qu’une complication infectieuse, survienne dans les suites d’une interven-
tion chirurgicale, d’un polytraumatisme, ou d’une hospitalisation en réanimation pour
un autre motif. Le marqueur idéal en réanimation devrait donc différencier la réaction
inflammatoire induite par une complication infectieuse nosocomiale de celle qui est
induite par la pathologie initiale, et faire la différence entre SIRS et sepsis. Par défini-
tion, aucun marqueur de l’inflammation ne permet cette distinction. La spécificité de
certains marqueurs vis-à-vis de l’étiologie infectieuse peut, pourtant, être observée dans
certaines conditions. Tout d’abord, l’intensité du stimulus nécessaire à l’augmentation
des marqueurs est variable en fonction du marqueur étudié. Certains sont augmentés
pour des réactions inflammatoires minimes voire localisées, d’autres nécessitent une
réponse inflammatoire systémique importante. L’intensité de la réaction inflammatoire
nécessaire à l’augmentation d’un marqueur, peut expliquer une apparente spécificité
pour l’étiologie infectieuse ; en effet l’infection bactérienne profonde s’accompagne
d’une réaction inflammatoire plus intense que d’autres étiologies. Le même marqueur
peut perdre cette spécificité si les patients présentent un syndrome inflammatoire im-
portant avant toute surinfection. Une deuxième explication pour qu’une telle spécificité
soit observée peut être fourni par le type de population étudiée. Si l’étiologie infectieu-
se est responsable de la grande majorité des complications inflammatoires susceptibles
de survenir dans cette population, l’augmentation d’un marqueur inflammatoire peut
alors apparaître comme étant spécifique de l’infection. Le marqueur inflammatoire idéal
en réanimation devrait être spécifique du sepsis. Or, il est probable que plus un mar-
queur est sensible vis-à-vis de la réaction inflammatoire, moins il est spécifique du
sepsis.
La concentration plasmatique du marqueur idéal ne doit pas dépendre des dysfonc-
tions d’organes. Or la synthèse et l’élimination peuvent être modifiées par l’existence
d’une insuffisance rénale ou hépatique, ou par les techniques d’épuration extra-rénale.
Il est donc important de choisir le marqueur en fonction des pathologies associées et
d’interpréter les résultats en tenant compte des modifications de pharmacocinétique
qui ne sont pas liées à l’intensité de la réponse inflammatoire.
Enfin, le marqueur idéal devrait être peu coûteux, or le dosage unitaire de certains
marqueurs est cher, et la réalisation d’une cinétique représente un coût non négligeable.
Il est donc important de choisir correctement le marqueur en fonction de l’objectif
diagnostique ou pronostique et de tenir compte de sa pharmacocinétique.
2. MARQUEURS DE L’INFLAMMATION EN REANIMATION
2.1. PROTEINE C REACTIVE (CRP)
La CRP est une protéine de 117,5 kDa qui est composée de 5 monomères [1-3]. Elle
a la propriété de précipiter avec le polysaccharide C du pneumocoque, d’où son nom.
C’est une protéine de la phase aiguë de l’inflammation qui est synthétisée par l’hépatocy-
te. Sa synthèse est essentiellement stimulée par l’interleukine 6 (IL6), mais également par
l’IL1ß et le TNF alpha. Sa concentration plasmatique normale est inférieure à 6 mg.L
-1
.
Son ascension est précoce dès la 10
e
heure en cas de réaction inflammatoire, et sa
concen-

Inflammation : nouvelles pistes 617
tration peut atteindre 1 000 fois la valeur basale en 48 heures. Cette molécule n’est pas
dialysée et sa concentration ne diminue pas en cas de syndrome néphrotique. Par con-
tre, sa synthèse est diminuée en cas d’insuffisance hépato-cellulaire, et la CRP n’est
plus fiable chez un patient cirrhotique sévère par exemple. Les glucocorticoïdes inhi-
bent également sa synthèse. Une augmentation modérée de sa concentration basale
peut être observée au cours de la grossesse ou en cas de contraception mais reste infé-
rieure à 15 mg.L-1. Une ascension plus importante autour de 30 mg.L-1peut être due à
l’hémodialyse chronique.
Les mécanismes d’action de la CRP ne sont pas totalement élucidés. Cette protéine
jouerait un rôle protecteur au cours de la réaction inflammatoire [4]. Sa capacité à lier
le pneumocoque protègerait l’organisme contre cet agent infectieux. Par ailleurs, la
CRP stimule la sécrétion de cytokines anti-inflammatoires par le macrophage, et est
capable d’activer le complément par la voie classique. Cette activation se produit lors-
que la CRP se fixe aux membranes cellulaires grâce à son affinité pour certains
phospholipides (PhL) et notamment les lysophosphatidylcholines (lysoPC). Or ces
lysoPC ne sont pas présents sur le feuillet externe des membranes de cellules intactes.
Leur présence pourrait être favorisée par l’action de la phospholipase A2 sécrétée de
type IIA (sPLA2) qui est capable d’hydrolyser les PhL membranaires, si leur répartition
est modifiée [5]. Schématiquement, alors que la membrane cellulaire normale est com-
posée d’un double feuillet au sein desquels les différents PhL sont répartis de façon
asymétrique par un phénomène enzymatique [6], l’action de certains médiateurs in-
flammatoires entraîne une perte de cette asymétrie de répartition [7]. Parmi ces
médiateurs, citons le TNFα, l’IL1ß, la fraction C5b9 du complément. Les PhL du feuillet
interne ne sont plus maintenus et sont extériorisés (flip-flop). Ce phénomène s’accom-
pagne de l’émission de microvésicules cellulaires (ectocytose) et d’une hydrolyse des
PhL par la sPLA2 qui génère des lysoPC [5]. La CRP peut alors se fixer à la surface de
ces membranes modifiées et agirait comme une opsonine, en activant le complément,
et en favorisant la phagocytose de ces cellules modifiées ou des microvésicules [8].
Rappelons que les cellules apoptotiques subissent ce flip-flop. La CRP agirait donc en
favorisant l’élimination de cellules en apoptose, de débris cellulaires ou de microvési-
cules.
En pratique, la CRP est un excellent marqueur diagnostic. Sa sensibilité pour con-
forter le diagnostic d’inflammation aiguë est élevée sans être fonction de l’étiologie.
Son augmentation est observée lors de réactions inflammatoires de faible intensité, et
n’est pas fonction du site de l’inflammation. Toutes les infections nosocomiales s’asso-
cient à une ascension de sa concentration, qu’il s’agisse d’infections sévères
(pneumopathie, bactériémie), ou d’infections moins symptomatiques (infection uri-
naire sur sonde, sinusite).
La CRP n’est pourtant pas un marqueur idéal en réanimation. Tout d’abord, la sen-
sibilité de ce marqueur est telle, qu’un traumatisme ou une intervention chirurgicale
entraînent son augmentation dès la 48e heure (Figure 1). Sa spécificité pour le diagnos-
tic d’infection n’est donc pas bonne, et des concentrations importantes
(> 200 mg.L-1) sont nécessaires pour que la CRP ait une valeur prédictive positive de
sepsis correcte (Tableau I).
Enfin, sa décroissance est lente (plusieurs jours) ; sa cinétique ne permet donc pas
de suivre l’évolution de la réaction inflammatoire au cours d’un état de choc septique
ou d’un SDRA par exemple. Les dosages plasmatiques peuvent donc être espacés de
3 à 5 jours, d’autant qu’ils sont coûteux.
D’autres marqueurs sont préférables s’il existe plusieurs stimuli de la réponse in-
flammatoire, ou si l’on souhaite suivre l’évolution quotidienne d’un SIRS.

MAPAR 2001618
2.2. PHOSPHOLIPASE A2 SECRETEE (SPLA2)
Les phospholipases A2 sont des enzymes qui hydrolysent les glycérophospholipides
membranaires en position sn-2 du glycérol, entraînant la libération d’un acide gras
libre et d’un lysophospholipide. La PLA2 sécrétée de type IIA [9-12] est également
nommée PLA2 synoviale (syn-PLA2), PLA2 plaquettaire, PLA2 sécrétée non-pancréati-
que (snp-PLA2), ou plus simplement sPLA2. Cette enzyme de 14 kDa comporte
124 acides aminés. Son activité est calcium-dépendante strictement extracellulaire. Elle
est sécrétée par un grand nombre de cellules [13] dont les mastocytes, les polynu-
cléaires neutrophiles, les plaquettes, les monocytes, les macrophages, les cellules en-
dothéliales, les cellules musculaires lisses, et les cellules mésangiales rénales. La
principale source plasmatique de l’enzyme dans l’inflammation systémique est incon-
nue. L’IL1ß et le TNFα sont les principaux inducteurs de cette sécrétion [14].
L’expression de la sPLA2 est par ailleurs stimulée par toute substance qui entraîne une
augmentation d’adénosine monophosphate cyclique (AMPc) intracellulaire. On peut
citer le LPS, la forskoline, la toxine cholérique, et les agonistes ß-adrénergiques. Les
anti-inflammatoires stéroïdiens (glucocorticoïdes) sont des inhibiteurs de sa synthèse,
ainsi que les prostaglandines qui exercent un rétrocontrôle négatif [15].
In vivo, l’injection intraveineuse de LPS augmente la sPLA2 plasmatique dont le
pic se situe deux à trois heures après l’augmentation d’IL1 et de TNF. L’injection intra-
veineuse de sPLA2 reproduit les effets observés lors de l’injection de LPS ou de TNF.
Elle entraîne une hypotension artérielle, et des lésions pulmonaires de SDRA. La sPLA2
modifie le surfactant [16, 17] et la compliance pulmonaire, et induit un infiltrat vascu-
laire et alvéolaire. Son injection intratrachéale entraîne des lésions de SDRA avec
bronchoconstriction, hypertension artérielle pulmonaire, et altération des pneumocytes
de type I et II [18]. In vitro, elle entraîne une dégranulation mastocytaire avec libéra-
Tableau I
Sensibilité, spécificité, valeur prédictive positive (VPP) et négative (VPN) de la
CRP, en faveur d’une infection bactérienne
(d’après Dupond et al. Rev Med Interne 1991).
Sensibilité (%) Spécificité (%) VPP (%) VPN (%)
CRP > 100 55 45 66 76
CRP > 150 35 65 74 63
CRP > 200 26 74 77 59
CRP en m
g
.L-1
Figure 1 : Modifications de CRP et de sPLA2 48 heures après chirurgie thoracique
(Fig 1a), et neurochirurgie (Fig 1b)
CRP et sPLA2 après neurochirurgie CRP et sPLA2 après chirurgie thoracique
120
100
80
40
20
0
60
400
350
300
250
200
150
100
50
0
CRP postop
sPLA
2
postop
Variables
Observations Observations

Inflammation : nouvelles pistes 619
tion d’histamine, une inhibition du chimiotactisme des polynucléaires neutrophiles avec
libération d’enzymes lysosomiales, et augmente la prolifération des lymphocytes T.
Elle participe à l’activation des facteurs du complément, à l’activation plaquettaire, et à
l’altération de l’endothélium vasculaire. Elle favorise l’expression de molécules d’ad-
hésion sur les polynucléaires. Les effets biologiques de la sPLA2 peuvent être classés
en deux catégories. Les premiers sont des effets directs dus à l’hydrolyse des PhL mem-
branaires. La paroi bactérienne est une cible privilégiée [19]. La sPLA2 possède une
activité bactéricide sur les bactéries Gram positives [20, 21], et sur les Gram négatives
en présence de BPI (bactericidal permeability increasing protein) [22, 23]. Le surfac-
tant pulmonaire, de nature phospholipidique, peut également être hydrolysé et perdre
ses propriétés tensio-actives. Une seconde catégorie d’effets peut être attribuée à la
sPLA2. En effet, cette enzyme est responsable de la libération de médiateurs lipidiques
pro-inflammatoires [24, 25]. L’hydrolyse d’un phospholipide entraîne la libération d’un
acide gras et d’un lysophopholipide. Si l’acide gras libéré est un acide arachidonique, il
constitue le substrat des cyclo-oxygénases (COX 1 et 2) et des lipo-oxygénases, et conduit
à la synthèse de prostaglandines et de leucotriènes. Par ailleurs, les lysophospholipides sont
de véritables médiateurs lipidiques comme le 1-O-alkyl-sn-glycéro-3-phosphocholine
qui
est à l’origine de la formation du facteur d’activation plaquettaire (PAF).
La sPLA2 est augmentée dans le plasma des patients (adultes et enfants) qui présen-
tent un sepsis, un choc septique, un SDRA, une pancréatite aiguë nécrotique, un syndrome
de défaillance multiviscérale, un paludisme, ou encore une intoxication aiguë salicylée.
Son augmentation est corrélée à celle de la CRP [26]. Elle n’est pas modifiée à la phase
aiguë des états de choc cardiogéniques, ou hémorragiques. Elle est augmentée dans le
plasma de patients qui présentent une inflammation systémique, indépendamment de
l’étiologie [27]. Les valeurs observées sont un reflet fiable de l’intensité de la réponse
inflammatoire. La sPLA2 est augmentée dans les sepsis et les chocs septiques quel que
soit l’agent infectieux. Les variations sont plus importantes dans les infections bacté-
riennes que dans les infections virales. La valeur et la cinétique de ce marqueur sont
corrélées à l’amplitude et la durée de l’hypotension artérielle au cours du choc septi-
que. Par contre, elle peut être inférieure à 10 U.mL-1 (valeur normale) chez des patients
qui présentent une méningite, une infection urinaire sur sonde, ou une sinusite. Elle
n’augmente pas dans le liquide céphalorachidien en cas de méningite.
La sPLA2 augmente rapidement dès la sixième heure en cas de stimulation. Sa demi-
vie est de six heures. Les valeurs les plus élevées (supérieures à 100 U.ml-1) sont
observées dans les chocs septiques d’origine bactérienne, dans les SDRA, et dans les
pancréatites aiguës nécrotiques. En pratique, c’est la cinétique plasmatique de cette
enzyme qui est intéressante. En effet, la sPLA2 diminue sensiblement dès la vingt-
quatrième heure en cas d’efficacité thérapeutique. Son augmentation reste fiable chez
les patients neutropéniques ou insuffisants hépatiques. Son activité plasmatique dimi-
Tableau II
Modifications de sPLA2 et de PCT après 8 heures d’hémofiltration continue chez
15 patients en réanimation.
H0 H8
sPLA2 (U/mL) 102 ± 20 75 ± 17
PCT (ng/mL) 81 ± 28 45 ± 16
Test de Student p = 0,003 p = 0,03
 6
6
 7
7
 8
8
 9
9
1
/
9
100%