Elaboration des métaux par voie thermique

JL 2005 – 2006 2 PC HdB
CHAPITRE I4
ÉLABORATION DES MÉTAUX
PAR VOIE THERMIQUE
La métallurgie est une pratique ancestrale, dont les balbutiements
remontent à l’âge de bronze. Les procédés d’élaboration des métaux,
jusqu’au 19ème siècle, consistent uniquement en une voie thermique, où
l’outil du chimiste est essentiellement le feu. Il existe une corrélation
évidente entre la date de mise au point de fours fonctionnant à une
température de plus en plus élevée et celle de l’élaboration de métaux de
plus en plus réducteurs. Ainsi la métallurgie du titane remonte-t-elle aux
années 1950. L’étude thermodynamique de ces procédés se fait à l’aide
des diagrammes d’ELLINGHAM. Ici les difficultés cinétiques sont peu
notables, compte tenu des conditions de travail, souvent à haute
température. La difficulté essentielle réside dans le fait que, souvent, les
réactifs sont solides et non miscibles.
Un autre procédé a été mis au point une fois découverts les phénomènes
d’électrolyse par FARADAY : il consiste en l’électrolyse des solutions
aqueuses de cations métalliques (ou de sels métalliques fondus). Ce
procédé sera étudié dans un chapitre ultérieur.
Comme le suggère le programme, nous nous appuyons sur l’étude des
procédés d’élaboration du zinc.

2 THERMODYNAMIQUE CHIMIQUE
1. MODÉLISATION THERMODYNAMIQUE
Intéressons-nous à la réduction d’un oxyde yx OM par le composé
M
′
. Les éléments
chimiques M et
M
′
sont soit des métaux, soit le carbone ou le dihydrogène. Le
système est fermé, maintenu à température et pression constantes (il subit des
transformations isothermes et isobares(1)).
Cette hypothèse
est très souvent
discutable.
Il s’agit de déterminer dans quelles conditions la transformation indiquée est possible.
Nous supposons que l’évolution de la composition du système est décrite par une
seule équation de réaction de la forme :
MOMMOM tzyx axccza +
′
=
′
+ (E)
La conservation de l’élément oxygène permet d’écrire la relation
ct
ay
=
entre les
différents nombres stœchiométriques introduits.
Considérons l’évolution thermodynamique d’un système comportant, à la température
T
et sous la pression
p
, les quatre constituants précédents, dans un état physique
déterminé. Comme nous l’avons montré dans les chapitres précédents, le sens de la
transformation est donné par le signe de l’affinité chimique de la réaction.
Plaçons-nous dans les modèles usuels : la phase gazeuse éventuelle est assimilée à
un mélange parfait de gaz parfaits et, pour des constituants en phase condensée,
négligeons la dépendance du potentiel chimique vis à vis de la pression.
Pour exprimer aisément l’affinité chimique, nous sommes amenés à faire des
hypothèses brutales sur l’état physique des différents constituants :
pour les oxydes : mis à part les cas du soufre, de l’azote, de l’hydrogène et du
carbone, les oxydes sont des composés solides, éventuellement liquides dans les
conditions de température et de pression habituellement utilisées. Pour simplifier,
nous supposerons que les phases condensées correspondantes sont pures (il n’y
a pas de miscibilité entre les différentes espèces), ce qui permet de prendre pour
les oxydes une activité égale à 1.
NOTE : dans le cas du soufre, de l’azote, du carbone et du dihydrogène, nous imposons
conventionnellement pour leurs oxydes gazeux une pression partielle égale à
°
p
.
pour les métaux : si la température n’est pas trop élevée, nous pouvons
considérer que les métaux restent en phase condensée, solide ou liquide. Nous
supposons également que les différentes espèces sont totalement non miscibles.
Ainsi l’activité d’un métal en phase condensée est prise égale à 1.
NOTE : si le métal est à l’état gazeux, ce qui est le cas à très haute température ou, pour le mercure, le
zinc ou le magnésium, à des températures plus raisonnables, nous prenons systématiquement sa
pression partielle égale à
p
°
. Par ailleurs, l’hypothèse de non miscibilité est souvent abusive mais
permet des calculs simples.
L’affinité chimique
A
de la réaction est donc systématiquement identifiée à l’affinité
chimique standard
( )
T
°
A et ne dépend donc plus que de la température du système,
dans le modèle volontairement simplificateur que nous avons adopté. Le signe de
(1) La transformation réelle est souvent assimilable à une évolution monotherme et monobare, pour laquelle nous utiliserions
les potentiels thermodynamiques adéquats,
H
~
et G
~
. Par ailleurs, l’opération industrielle de réduction de l’oxyde est
rarement menée en système fermé, mais le plus souvent en régime stationnaire.

[I4] élaboration des métaux par voie thermique 3
l’affinité, donc le sens de l’évolution du système, ne dépend donc que de la
température.
L’équation de réaction (E) est une combinaison linéaire des équations de formation
des oxydes que nous écrivons sous la forme :
tz2 OM
2
OM
2′
=+
′
t
t
z
(
)
M′
F
yx2 OM
2
OM
2yy
x=+
(
)
M
F
ATTENTION !
Ces équations de formation ne sont pas les équations que nous
avons écrites dans le chapitre 3
, pour lesquelles le nombre stœchiométrique de
l’oxyde est égal à 1. Ici, elles sont écrites avec systématiquement le même
nombre
stœchiométrique pour le dioxygène – ici égal à
( 1)
−
–
, de façon à faire apparaître
l’équation globale comme une simple différence d’équations de formation.
Compte tenu des relations entre les différents paramètres, l’équation (E) s’écrit alors :
( ) ( ) ( )
[ ]
MM
2′
−⋅= FF
a
y
E
Elle apparaît donc, à un coefficient multiplicatif près, comme une simple différence
d’équations de formation, ce qui justifie le choix d’écriture adopté.
NOTE : remarquons que l’équation de réaction peut être considérée comme la combinaison linéaire
de deux demi équations de transfert d’une molécule de dioxygène entre deux métaux. Le
parallélisme est alors immédiat avec le formalisme de l’oxydoréduction en solution aqueuse, où la
particule échangée entre forme réduite et forme oxydée est un électron de transfert.
La relation de permet d’écrire l’expression de l’affinité chimique standard de (E), sous
la forme :
(
)
M M
(E) r ( ) r ( )
2
( ) F F
y
T G G
a
′
° ° °
= ⋅ ∆ −∆A
Harold Johann
ELLINGHAM,
chimiste anglais
(1897-1975).
Il suffit donc de connaître les expressions des enthalpies libres standard des
équations précédentes de formation des oxydes pour déterminer le signe de l’affinité
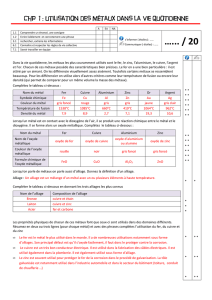
chimique et le sens d’évolution du système. Pour cela, nous pouvons représenter
dans un plan
(
)
TTG ),(
r°∆ les courbes correspondantes et, graphiquement, obtenir
le résultat. Une telle représentation a été proposée par ELLINGHAM vers 1950 et
porte son nom.
En pratique, il est possible aussi de travailler sur les chlorures et les sulfures au lieu
des oxydes. Les raisonnements effectués sont exactement de la même nature.
2. DIAGRAMME D’ELLINGHAM
2.1. Enthalpie libre standard de formation d’un oxyde
Considérons l’équation
(
)
M
F de formation d’un oxyde à partir d’un métal et de
dioxygène. Le nombre stœchiométrique du dioxygène est pris égal à
( 1)
−
. L’équation
générale se met sous la forme :

4 THERMODYNAMIQUE CHIMIQUE
yx2 OM
2
OM
2yy
x=+
Sauf cas très particulier, l’oxyde est solide, au pire liquide dans les conditions
utilisées. Le métal, en revanche, peut prendre les trois états physiques.
L’approximation
d’ELLINGHAM (ch.
3) consiste à
prendre
indépendantes de
la température
l’enthalpie stan-
dard et l’entropie
standard de
réaction.
Nous utilisons l’approximation d’ELLINGHAM , qui permet de linéariser l’expression de
l’enthalpie libre standard de la réaction sur des domaines de température où il n’y a
pas de changement d’état. Les courbes sont donc des fonctions affines par
morceaux, les domaines étant limités par les températures de changement d’état du
métal et de son oxyde. Ces courbes sont continues, puisque le potentiel chimique du
constituant qui change d’état prend la même valeur pour les deux états physiques à
la température de changement d’état. Les données thermodynamiques nécessaires
sont disponibles dans les tables thermochimiques : enthalpies standard de formation
à K298
0=T, entropies standard à K298
0=T, enthalpies standard de changement
d’état.
Ainsi, la réduc-
tion par le carbone
du dioxyde de
titane TiO2,
réalisée vers
2500 K, ne
conduit pas à la
formation de
titane mais de
carbure de titane
TiC.
Nous limitons l’étude à un domaine de valeurs de la température comprises entre
K300 et K0002 . En deçà de la première borne, les réactions sont trop lentes pour
être envisagées et, au delà de la seconde borne, de nombreuses réactions parasites
peuvent intervenir et modifier considérablement les résultats des prévisions.
REMARQUE : si nous excluons le cas de l’hydrogène, du carbone, de l’azote et du
soufre, pour lesquels les oxydes sont gazeux, nous constatons que la somme
des nombres stœchiométriques des constituants gazeux est négative quelle que
soit la valeur de la température. L’entropie standard de réaction a donc un signe
négatif et la fonction )(
rTG°∆ est croissante.
2.2. Exemple : l’oxyde de zinc ZnO
Tableau 4.1 – Données thermodynamiques relatives au zinc
cr
Zn cr
ZnO gaz2
O
1
fmolJ/)K298( −
⋅°∆ H 0 5
1048,3 ×− 0
11 molKJ/)K298( −− ⋅⋅°S 6,41 6,43 205
K/
fus
T 693 2250
1
fus molJ/)K693( −
⋅°∆ H 3
107,6 ×
K/
éb
T 1801
1
vap molJ/)K1801( −
⋅°∆ H 3
10115×
Nous allons mener l’étude sur l’exemple de la formation de l’oxyde de zinc ZnO . Ce
dernier est solide dans tout le domaine de température envisagé. L’équation de
formation, écrite conventionnellement avec le nombre stœchiométrique du dioxygène
égal à
( 1)
−
est la suivante :

[I4] élaboration des métaux par voie thermique 5
ZnO2OZn2 2=+
L’enthalpie libre standard de formation de l’oxyde de zinc se calcule par la relation
suivante : )()()( 0r0rr TSTTHTG °∆⋅−°∆=°∆ avec :
L’enthalpie stan-
dard de formation
du dioxygène est
nulle puisque ce
composé est l’état
standard de réfé-
rence de l’élément
oxygène.
)(2)(2)( 0Znf0ZnOf0r THTHTH °
∆−
°
∆=°∆
)()(2)(2)( 0O0Zn0ZnO0r 2TSTSTSTS °
−
°
−
°
=°∆
Les valeurs de l’enthalpie standard de formation du zinc et de son entropie standard
absolue dépendent de la température, puisque l’état standard de référence du zinc
dépend de T. Nous savons qu’il représente la forme physique la plus stable du zinc,
pris pur, sans défaut, à la température T et sous la pression standard :
si 693K <T : il s’agit de cr
Zn ,
si 1801K693 <<T : il s’agit de liq
Zn ,
si 1801K >T : il s’agit de gaz
Zn , assimilé à un gaz parfait.
Nous étudions par conséquent la fonction dans les intervalles de température ci-
dessus délimités.
Les enthalpies standard de formation de liq
Zn et gaz
Zn à K298
0=T sont
calculables, dans l’approximation d’ELLINGHAM, par l’intermédiaire des enthalpies
standard de changement d’état :
)K693()K298()K298( crliqliq ZnfusZnfusZnf °
∆≈
°
∆=
°
∆HHH
)K298()K298()K298( liqliqgaz ZnfZnvapZnf °
∆+
°
∆=
°
∆HHH soit :
)K298()K298()K298( crliqgaz ZnfusZnvapZnf °
∆+
°
∆=
°
∆HHH
Dans l’approximation d’ELLINGHAM, cette grandeur est indépendante de la
température, ce qui nous donne la relation suivante :
)K693()K1801()K298( crliqgaz ZnfusZnvapZnf °
∆+
°
∆≈
°
∆HHH
Il nous faut maintenant déterminer les valeurs de l’entropie standard absolue du zinc
à l’état liquide et à l’état gazeux. Pour cela, nous écrivons qu’à la température de
changement d’état, le potentiel chimique standard du zinc pur prend la même valeur
dans les deux phases. Par exemple, pour la fusion du solide, nous avons à la
température
fus
T
:
)()( fuscrfusliq TT °
µ=
°
µ
Cette relation se traduit par : )()()()( fuscrfusfuscrfusliqfusfusliq TSTTHTSTTH °
⋅−
°
=
°
⋅−
°
Nous en déduisons : fus
fuscrfusliq
fuscrfusliq
)()(
)()( T
THTH
TSTS °−°
+
°
=
°, soit :
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
1
/
16
100%