polycopié - Scientia Terrae

M. CHAMBARD.
Comprendre
Première S
Comprendre
Activité documentaire
Description et quantification des
interactions fondamentales
IILes interactions fondamentales.
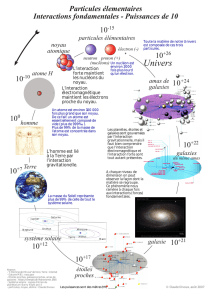
Document n°1. Les interactions fondamentales.
Dans la conception
contemporaine, il faut
entendre par force non
seulement ce qui pousse,
qui tire ou modifie le
mouvement, mais aussi tout
ce qui incite au changement,
à la métamorphose.
La force, ou mieux
l’interaction, dans
l’acceptation physicienne, se
définit donc comme l’agent
unique de la transformation.
Les interactions sont au
nombre de quatre :
— forte ;
— faible ;
— électromagnétique ;
— gravitationnelle.
Elles sont hiérarchisées en
portée et en intensité.
À l’échelle du noyau
atomique, l’interaction forte
domine en intensité toutes
les autres, dont l’interaction
électromagnétique, laquelle
surpasse l’interaction faible,
qui elle même laisse très
loin derrière la minuscule
interaction gravitationnelle.
Pourtant cette hiérarchie
microscopique ne reflète
pas en rien l’influence de
ces interactions à grande
échelle.
La gravitation est sans
conteste dominante à
l’échelle cosmique, parce
qu’elle n’est compensée par
aucune antigravitation, et
que son intensité, bien que
déclinante, s’exerce sans
limite de distance. Elle est
toujours attractive et de
portée infinie.
Les interactions forte et
faible, de par leur portée
minuscule, respectivement
10
−15
m et 10
−17
m, se sont
fait un royaume du noyau et
de l’atome.
Quant à l’interaction
électromagnétique, bien
que de portée infinie, elle
ne saurait gouverner le
vaste cosmos car, dans
les grandes structures, les
charges électriques positives
et négatives, en nombre égal,
partout se neutralisent.
Cette interaction, attractive
ou répulsive, n’est pour
autant pas une force
négligeable : elle a pris
possession du vaste
domaine laissé vacant entre
l’atome et les étoiles, qui
inclut le minéral, l’animal, le
végétal et l’Homme.
Document n°2. Formation de l’univers : le Big Bang.
Compilé par M. CHAMBARD à 13:59. Page no1/4

1Quelles sont les quatre interactions fondamentales ?
2Seulement deux interactions interviennent à notre échelle. Lesquelles ? Justifiez.
3Pourquoi l’interaction gravitationnelle nous est-elle plus familière que l’interaction électromagnétique ?
4Complétez le tableau suivant à l’aide du document n°1.
Interaction Portée Échelle ou édifice majoritairement
concerné
5A l’aide du tableau suivant, dite quelle interaction domine à chaque étape de la formation de l’univers.
Étape 1 2 3 4 5 6 7
Interaction
prépondérante
IIII Modélisation classique de ces interactions, les forces.
Une manière de modéliser les interactions consiste à utiliser les forces vues en seconde.
Dans cette partie, on considère un noyau d’hélium 4. Sur cette représentation ci-dessous, les protons sont en rouge et les
neutrons sont en bleu.
30pm
1fm
Données.
—
Masse d’un proton ou d’un neutron :
mp=mn=
1,67·10−27 kg
—
Constante de la gravitation universelle :
G=
6
,
67
·
10−11 m3·kg−1·s−2
— Charge d’un proton : qp=1,60 ·10−19 C
—
Constante électrique :
k=1
4π²0
=
9
,
0
·
109N·m2·C−2
— Masse d’un électron : me=9,1·10−31 kg
Document n°3. La nature des lois physiques (Richard Feynman).
La force électrique varie comme l’inverse du carré de la distance, mais, ce qui est remarquable, c’est la colossale différence
entre l’intensité (norme) des forces électriques et des forces gravitationnelles. Deux électrons se repoussent l’un l’autre
selon l’inverse du carré de la distance à cause de l’électricité, et s’attirent selon le carré de la distance, à cause de la
gravitation.
1Quelle est la composition du noyau d’hélium 4?
2Force gravitationnelle dans l’atome d’hélium 4.
a)
Rappelez la loi de gravitation universelle qui donne l’expression de l’intensité de la force gravitationnelle
Fg
qu’exercent l’un sur l’autre deux objets Aet B, de masses respectives mAet mBet séparés d’une distance centre à centre d.
b) Calculez la force gravitationnelle qui existe entre deux protons.
c) Calculez la force gravitationnelle qui existe entre le noyau et un électron.
Compilé par M. CHAMBARD à 13:59. Page no2/4

3Dans le document n°3, Richard Feynman évoque l’existence d’une force électrique. Cas de l’atome d’hélium 4.
a)
Quelle action mécanique (interaction) modélise cette force ? Est-ce une action mécanique de contact ou à distance ?
Pour chaque système, dites si l’action mécanique est attractive ou répulsive.
b)
Quelle information vous fait penser que l’expression de l’intensité de cette force électrique est similaire à celle de la
force gravitationnelle ?
c)
On note
qA
la charge de la particule
A
et
qB
celle portée par la particule
B
,
k
une constante et
d
la distance qui
sépare les deux particules de centre à centre.
Parmi celles proposées ci-dessous, quelle expression pourrait traduire l’intensité de la force électrique Fe?
—Fe=k·d
|qA|·|qB|—Fe=k·|qA|·|qB|
d2—Fe=k·|qA|·|qB|
d—Fe=k·d2
|qA|·|qB|
d) Calculez l’intensité de la force électrique entre les deux protons.
e) Calculez l’intensité de la force électrique entre le noyau et un électron.
4Interaction entre les deux protons.
a) Calculez Fe
Fg
.
b)
Si aucune autre interaction ne s’exerce entre ces
deux particules, que devrait-il se passer ?
c) Concluez.
5Interaction entre le noyau et un électron.
a) Calculez Fe
Fg
.
b) Concluez.
IIIIII Description moderne de ces interactions, le modèle standard.
Document n°4. Composition et charge du noyau : aspect historique.
Après l’expérience de
RUTHERFORD
, on a cherché à déterminer la composition du noyau. L’une des premières choses que
l’on a pu déterminer est sa charge.
En effet, Antonius van den Broek émet l’hypothèse que la place de chaque élément dans la classification périodique est
égale à la charge de son noyau. Cette hypothèse est confirmée expérimentalement par Henry Moseley en 1913.
De plus, on sait depuis le début du XIX
e
siècle que le noyau est chargé positivement. Mais comment quantifier
a
les
différentes charges possibles du noyau?
En 1919, Rutherford prouve que le noyau de l’atome d’hydrogène est présent dans les autres noyaux. Ainsi, on en déduit
que le noyau est constitué d’une particule chargée appelée proton et qu’il constitue la charge élémentaire de la matière.
De plus, on a établi que l’atome d’hydrogène est constitué d’un proton et d’un électron. Afin d’assurer l’électroneutralité de
l’atome, on en déduit que la charge de l’électron est opposée à celle du proton.
Pour finir, une autre série d’expérience a permis de mettre en évidence l’existence du neutron dans le noyau en 1930.
a. On rappelle que QUANTIFIER signifie donner une mesure.
DÉFINITION :« Charge élémentaire ».
CHARGE ÉLÉMENTAIRE.
Notée
e
, la charge élémentaire est le plus petit multiple de la charge du noyau ou de l’électron.
e=1,602·10−19 C
Document n°5. Éléments de physique des particules.
Dans l’état des
connaissances en 2015, la
matière est constituées de 12
particules
élémentaires
,
appelées fermions,
regroupées dans le tableau
no1.
À partir de ces particules
élémentaires, on peut
construire des particules
composées
. Parmi celles-
ci, il y a les baryons qui sont
la combinaison de 3 quarks.
Parmi les baryons, il y a :
—
les protons qui sont
constitués de deux
quarks up et un quark
down.
—
les neutrons qui sont
constitués de deux
quarks down et un
quark up.
Schéma n
o
1 –
Représentation d’un baryon.
uu
d
Les particules élémentaires
de matière peuvent échanger
de l’énergie à l’aide de
particules élémentaires,
appelées bosons, regroupées
dans le tableau no1. Il y a :
Compilé par M. CHAMBARD à 13:59. Page no3/4

—LES GLUONS
permettant de décrire l’interaction forte. Cette dernière permet d’expliquer la cohésion des quarks dans
les baryons et la cohésion des neutrons et de protons dans le noyau par échange de gluons entre les quarks (vaguelettes
jaunes).
—LES PHOTONS
qui modélisent l’interaction électromagnétique dont la lumière est l’une des manifestations. Elle explique
la cohésion de l’atome.
—LES BOSONS W±ET Z°
qui expliquent certaines transformations nucléaires comme la désintégration
β
. Cette
désintégration est au cœur de la nucléosynthèse des étoiles.
—LES BOSONS DE HIGGS qui donnent la masse aux autres particules.
Tableau n
o
1 – Récapitulatif des particules élémentaires. Les charges sont données en multiples de
e
, la charge élémentaire.
Pour finir, le modèle standard ne prévoit pas de médiateur de l’interaction gravitationnelle comme les gluons ou les
photons. Mais la théorie quantique des champs prévoit l’existence d’une particule qui remplit cet office, le graviton. Mais à
ce jour, rien ne prouve son existence.
Ce dernier document n’est qu’une explication très simplifiée du modèle standard. Aucune notion de ce modèle n’interviendra
dans les évaluations.
1Quelles sont les deux particules élémentaires déjà abordées cette année ? On précisera à quelle occasion.
2Quelles sont les deux particules représentés dans le noyau ? Sont-elles des particules élémentaires ?
3Quelle interaction assure la cohésion du noyau ? Nommez la particule associée dans le modèle standard.
4Quel est le baryon représenté sur le schéma no1? Justifiez.
5Quelle est la charge du proton? Le justifier par deux moyens.
6Déduisez de l’atome d’hydrogène, la charge d’un électron.
7Calculez la charge d’un neutron ? Justifiez.
Compilé par M. CHAMBARD à 13:59. Page no4/4
1
/
4
100%