PSI samedi, 21 Janvier 2017 2016/2017 DEVOIR SURVEILLE DE

PSI samedi, 21 Janvier 2017
2016/2017 DEVOIR SURVEILLE DE PHYSIQUE N° 4
8h00 – 12h00 4 heures
Calculatrices autorisées
NB: Le candidat attachera la plus grande importance à la clarté, à la précision et à la concision de la
rédaction.
Toutes les interprétations physiques seront comptabilisées
Si un candidat est amené à repérer ce qui peut lui sembler être une erreur d'énoncé, il le signalera
sur sa copie et devra poursuivre sa composition en expliquant les raisons des initiatives qu'il a été
amené à prendre. * * *
Le devoir se compose de trois problèmes
Premier problème : Dosage du pentaoxyde d’azote dans l’atmosphère (25% du barême)
Dans l’atmosphère, le dioxyde d’azote NO2 entre dans une chaine de plusieurs réactions menant à
la fabrication d’ozone O3, gaz toxique. On obtient par ailleurs de nombreux produits dérivés et
notamment du pentaoxyde de diazote N2O5. En atmosphère humide, N2O5 réagit au cours d’un
mécanisme non détaillé ici mais dont le bilan est le suivant :
N2O5 (g) + H2O(liq) → 2 NO3- (aq) + 2 H+ (aq)
On obtient donc une solution aqueuse d’acide nitrique. Cette réaction atmosphérique (supposée
totale) amplifiée par les polluants issus des pots d’échappement contribue au phénomène des
pluies acides.
On souhaite ici utiliser cette réaction pour déterminer la concentration en N2O5 (g) présent dans les
gaz d’échappement d’un moteur thermique d’un groupe électrogène alimenté avec du gazole. Pour
cela, on fait barboter 1 m3 de gaz d’échappement dans un 1L d’eau. On admet que la totalité des
nitrates NO3- se retrouve en solution aqueuse acide. On souhaite alors doser les nitrates NO3- (aq)
suivant le protocole décrit en ANNEXE 1.
1. Dans le cadre d’un diagramme potentiel-pH, déterminer l’équation de la droite donnant les
variations du potentiel du couple NO3-(aq) / NO2-(aq) en fonction du pH. On prendra [NO3-(aq) ] =
[NO2-(aq)] comme convention de frontière.
2. Calculer le coefficient directeur de la frontière oblique séparant les domaines et du
diagramme potentiel – pH simplifié du Cadmium.
3. En utilisant le document-réponse (en fin de sujet en ANNEXE 2 et à rendre avec la copie),
justifier graphiquement que la réaction entre le cadmium métallique et les ions nitrate est
quantitative.
Ecrire l’équation de la transformation chimique correspondante, en milieu acide.
4. Pourquoi a-t-on choisi une longueur d’onde de 540 nm ?
5. La loi de Beer-Lambert est-elle vérifiée au cours du protocole réalisé ?
6. Déterminer la concentration massique en acide nitrique initialement présent dans la solution S0.
En déduire la concentration massique initiale en N2O5 (exprimée en mg par m3 de gaz
d’échappement).

Deuxième problème :
Paramètres électriques d’une bobine et courants de Foucault (25% du barême)
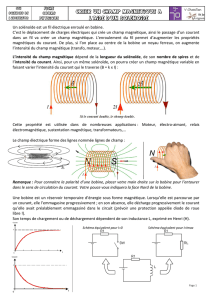
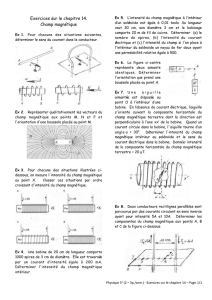
On considère une bobine d’axe z, sans noyau, d’inductance propre LH et de résistance
électrique RΩ, parcourue par un courant électrique ie(t) = Ieff√2 cos(ωt) . On note Hb la longueur de
cette bobine. Il règne alors dans cette bobine un champ magnétique :
zeoz utniµutBB )()(
, où n
est le nombre de spires par unité de longueur de la bobine et µo la perméabilité magnétique du vide.
On place intégralement à l’intérieur de cette bobine un tube métallique de même axe z que la
bobine représentée à la figure 5. On note Rt son rayon moyen, e son épaisseur supposée très fine
devant le rayon Rt et Ht sa longueur supposée inférieure à celle de la bobine (Ht < Hb).
Ce conducteur métallique est caractérisé par sa conductivité électrique γ. D’un point de vue
magnétique, il est ici assimilé à du vide.
On négligera les effets de bord. Le repère utilisé sera celui des coordonnées cylindriques (r,
θ, z) de base :
),,( zr uuu
.
1. Expliquez pourquoi des courants électriques prennent naissance dans le tube conducteur.
Les lignes de courants induits sont-elles colinéaires à
r
u
, à
u
ou à
z
u
?
2. On note
e
j
la densité volumique de courant associée à ces courants induits, aussi appelés
courants de Foucault.
Préciser l’unité de
e
j
.
Rappeler l’expression de l’équation de Maxwell-Faraday.
Par un calcul de circulation sur un contour qu’on définira, déterminer l’expression du champ
électrique induit dans le tube en fonction de B(t) et de r.
En déduire l’expression de
e
j
en fonction de γ , B(t) et de r.
3. Le tube conducteur est suffisamment fin pour considérer que r = Rt dans tout le tube.
Déterminer en fonction des paramètres géométriques du tube, du champ magnétique B(t) et de la
conductivité électrique γ, la puissance instantanée P(t)c.f. dissipée par les courants de Foucault.
En déduire que la puissance moyenne Pc.f ., dissipée par les courants de Foucault dans le tube, est de
la forme Pc.f. = C2.Ieff2. Préciser l’expression de C en fonction de µo, γ, n et des caractéristiques
géométriques du tube.
On note R’Ω la résistance apparente de la bobine en présence du tube conducteur.
Donner l’expression de R’Ω puis comparer simplement R’Ω et RΩ .
4. Dans le cas où le tube conducteur présente une fissure orthoradiale parallèle au plan
),(
uur
(figure 6a), la distribution des courants de Foucault est-elle modifiée ? Qu’en est-il pour la
puissance Pc.f . ?

Dans le cas où le tube conducteur présente une fissure axiale parallèle à l’axe z’z, (figure 6b), la
distribution des courants de Foucault est-elle modifiée ? Qu’en est-il pour la puissance Pc.f . ?
5. Rappeler la loi de Lenz. La présence de courants de Foucault modifie-t-elle l’inductance
apparente L’H de la bobine ? Si oui, comparer simplement L’H et LH .

Troisième problème :
Suspension magnétorhéologique (50% du barême)
La suspension sur un véhicule est le terme donné au système composé des ressorts, des
amortisseurs et des liaisons mécaniques qui connectent le châssis du véhicule aux roues. Dans une
suspension, l’amortisseur joue un rôle central en répondant à un double objectif : il contraint
l’élasticité du ressort de suspension et limite ainsi les mouvements oscillatoires du véhicule ; il
freine le rebond des roues sur les obstacles et maintient celles-ci en contact avec le sol. La
modification continue de l’état de la route et des exigences sur la tenue en virage oblige à modifier
les caractéristiques de réponses des suspensions. C’est le cas de cette suspension qui est capable de
faire varier la raideur de l’asservissement roue par roue. Pour contenir les mouvements de caisse et
préserver le confort sur chaussée dégradée, la vitesse de déplacement de la suspension devra être
très précise. Ce sujet concerne donc la caractérisation d’un nouveau type de suspension utilisant un
fluide magné- torhéologique et son asservissement. Les exigences désirées par les constructeurs
l’utilisant (Audi, Ferrari,...) sont fournies et représentées dans le tableau 1.
La suspension magnétorhéologique (MR), ou MagneRide (dénomination commerciale), fait
appel à des amortisseurs à orifices fixes et fluide magnétorhéologique. En cas de besoin de
raidissement, les bobines électriques à la périphérie de l’orifice sont alimentées en courant, ce qui
provoque l’attraction des particules souples magnétisées en suspension dans le fluide et augmente la
résistance à l’écoulement.
Pour caractériser les paramètres de cette suspension, une suspension MR de taille réduite
sera montée sur un banc d’essai et sollicitée. On étudie une modélisation de l’influence du caractère
ferromagnétique du fluide, puis une modélisation du circuit magnétique de l’amortisseur.
Description de l’amortisseur à fluide magnétorhéologique :
L’amortisseur exerce sur la roue une force d’amortissement de la forme F = − αV où V est la
vitesse de la roue perpendiculairement à la route. L’amortisseur est constitué d’un fluide enfermé

dans un cylindre de révolution d’axe (
Oz
). À l’intérieur de ce cylindre se trouve un piston, de
même diamètre que le cylindre, percé d’une valve. On suppose que le piston coulisse sans
frottements à l’intérieur du cylindre.
Le fluide enfermé dans le cylindre est ici huile. Lorsque le véhicule roule sur une
anfractuosité de la route, le piston se déplace dans le cylindre et le fluide passe d’un côté à l’autre
du piston en s’écoulant par la valve.
Le corps du piston est constitué d’un matériau ferromagnétique doux (acier) et d’une bobine
parcourue par un courant électrique d’intensité i. Le tout forme un circuit magnétique dont la valve
est l’entrefer.
Données et notations utilisées
Les données ci-dessous sont celles de l’amortisseur de taille réduite utilisé pour réaliser les expé-
riences :
– perméabilité magnétique relative de l’acier : µ1≈ 5 000 ;
– perméabilité magnétique relative de l’huile MR : µ2 ≈ 2,5 ;
– rayon du piston (S p sa surface) : rp = 10 mm ;
– rayon interne de la valve : r1 = 7,0 mm ;
– rayon externe de la valve : r2 = 8,0 mm;
– rayon moyen de la valve : rm ;
– circonférence moyenne de la valve : w = 2πrm ;
– épaisseur de la valve : e = 1,0 mm ;
– longueur du piston : L = 20 mm ;
– vitesse caractéristique de déplacement du piston : 0 < V0 < 100 mm.s−1 ;
– intensité du courant électrique circulant dans la bobine : i ;
– nombre de spires (jointives) de la bobine : N ;
– rayon interne de la bobine : ro = 3,0 mm ;
– hauteur de l’entrefer : h = 1,0 mm
Sur les figure 5.(b) et figure 5.(c) et dans toutes les suivantes, le fluide circule dans la partie
annulaire en gris foncé.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%