chageur batterie plomb - Des engins électriques à l`IUT GEII de

1
I.U.T GEII de Soisson, Cuffies Aisne 02
En espérant que l’histoire que nous allons vous compter va vous séduire
Les programmes ainsi que les typons sont en sources libres sur notre site d’étudiants
www.AEGEII.fr
GENIE ELECTRIQUE ET
INFORMATIQUE INDUSTRIELLE
Professeur :
M. A.SIVERT
Réalisation : Monchanin Maxime
Lepage Benjamin
Mikusiak spephane
Charlot olivier
2 batteries
Afficheur LCD
Selectionneur par
BP
Inductance de filtrage et
capteur de courant PIC 16F877
Alimentation
flyback
24V/25A
2*Hacheur abaisseur

2
Page
1. CARACTERISTIQUES ELECTRIQUES DES BATTERIES AU PLOMB
2. ETUDE DES CHARGEURS DU COMMERCE
3. LE CAHIER DES CHARGES :
3.1. CHARGEUR 2X12V/20A AVEC PIC 16F877
4. ETUDE DE LA MESURE DE COURANT ET TENSION
5. ETUDE ET TEST DU HACHEUR
6. CARTE AFFICHEUR LCD, BUZZER ET BOUTON POUSSOIR
7. CARTE MESURE TEMPERATURE
8. TYPON DES 4 CARTES
3
4
5
8
9
20
21
22
9. ETUDE DE LA REGULATION
LOGIQUE FLOUE POUR CHARGEUR RAPIDE DE BATTERIES
23
24
10. SIMULATION DU CHARGEUR AVEC UNE BATTERIE
11. SECURITE ELECTRIQUE DU CHARGEUR
31
32
12. PROGRAMME DE TEST ET PROGRAMME DU CHARGEUR DE BATTERIE
13. ETUDE DU BILAN ENERGETIQUE DU CHARGEUR DE BATTERIE
32
33
14. ETUDE DE LA CARTE MICROCONTROLEUR AVEC LE PIC 18F6520
34
15. COMMENT DIAGNOSTIQUER UNE BATTERIE DEFAILLANTE ?
36
16. PRORAMME ET TEST DE LA DESULFATISATION
37
17. PROGRAMME ET TEST DE LA CHARGE D’ENTRETIEN
40
18. CONCLUSION GENERALE
41
Que ferez-vous demain pour changer le monde ?
Passe le relais pour un « monde meilleur »
Introduction
Les batteries au plomb doivent être toujours chargées pour qu’elles ne s’oxydent pas (sulfatisation).
Lors de l’utilisation de karting, il faut charger rapidement les batteries. Mais, il faut des charges lentes
dites d’entretien. Le karting et les scooters électriques ont 4 batteries en série. Cette étude va permettre
de réaliser 4 chargeurs unitaires.
L’avantage d’avoir 4 chargeurs unitaires est d’arrêter la charge de chaque batterie de façon
indépendante à cause des dissymétries qu’elles peuvent avoir.

3
1. Caractéristiques électriques des batteries au plomb
Borne - :
-
4
2
4
e2+PbSO=>)SO(+Pb
Borne+ :
24
2
42
e2-OH2+PbSO=>H4+)SO(+PbO
On peut observer sur la figure suivante une
batterie au plomb chargée. L’acide est du
sulfate de plomb. La force électromotrice de
la batterie dépend de la densité d’acidité.
Donc, une batterie est modélisée par un
générateur de tension E
B
en série avec
une résistance.
La transformation chimique correspond à
l’équation suivante :
0H2+PbSO=HSOH2+OPb+Pb
24422
On peut voir cette transformation sur la
figure suivante ou il y a 2 électrons qui
sont libérées lors de la décharge.
Lorsque la batterie se décharge l’acidité
diminue est du sulfate de plomb se met sur
les électrodes.
A 15% d’acidité la batterie est considérée
déchargée.
Lors de la charge, il y a du dihydrogène sur
la borne + qui s’échappe sous forme de gaz
et sur la borne – du dioxygène.
Plus, la tension de charge est importante et
plus de dégagement de gaz est important
donc, il y a une perte très faible d’eau.
C’est pour cela que pour les batteries au gel,
la tension maximale est de 14V pour
minimiser ce dégagement, et qu’il faut
parfois rajouter de l’eau dans une batterie
liquide.
1. Fig : Courbe de la variation de la
tension en fonction de l’acidité pour
un élément de batterie au plomb.
En fonction du nombre de charge et de décharge, la réaction chimique n’est pas entièrement réversible
et les électrodes restent sulfatées au bout d’un certain temps. Cette sulfatation est plus importante si la
batterie est déchargée, donc il faut que la batterie soit toujours chargée. Mais, la batterie perd 1% à 5 %
de sa capacité énergétique tous les jours. Donc pendant, un long séjour d’inactivité, il faut que la
batterie reçoive une charge d’entretien quotidiennement.
Nous allons voir quels sont les chargeurs qui existent dans le commerce et comment il charge les
batteries.

4
2. ETUDE DES CHARGEURS Du COMMERCE
Tous les chargeurs chargent à courant constant (principe des branchements des sources de type
contraire) puis limite la tension à une valeur limite pour ne pas avoir trop de dégagement gazeux aux
niveaux des électrodes. La courbe de charge est représentée sur la figure suivante :
2. Fig : charge d’une batterie au plomb idéal
Il y’a 4 fabricants à l’heure actuel qui fabrique des chargeurs rapides depuis quelques années :
2006 : DOLPHIN PAR SPEEDONAX (12V, 40A) 4 leds d’état, chargeur analogique ou la
tension de saturation peut être réglée avec une résistance ajustable de 14V à 15V (350 €).
2008 : CHARGEUR C-TECK (12V, 25A) avec 2 boutons et 4 leds (200 €)
Celui-ci fait une désulfurisation pour l’entretien des batteries. Puis, il y a une charge d’entretien
que l’on appel floating.
2009 : CHARGEUR GYS (12V, 20A) avec afficheur LCD 2 lignes 32 caractères INEVERTER
20HF.
Le courant est réglable mais pas la tension de saturation (250 €).
GYS fait aussi un chargeur 40A pour 350 € et 70A pour 435 €.
2007 Teksup (12V/20A) avec 3 leds
(200€). on peut voir la photo sur la
figure suivante.
2005 Hyperion (2*12V/10A/200€).
Il y a un afficheur LCD qui indique la tension,
la capacité énergétique, le courant…
Ce chargeur est utilisé pour le modélisme, il
faut lui rajouter une alimentation 24V/25A
(50€). Il peut charger tous types de batteries.
Sur tous ces chargeurs, il n’y a pas beaucoup d’indication de l’état de charge (exemple la valeur du
courant, la tension des batteries…). Il y a juste quelques leds qui indiquent lorsque la batterie est finie
d’être chargée.
Donc, nous allons proposer de réaliser un chargeur qui indiquera l’état de la charge, mais
diagnostiquera aussi l’état de la batterie. Le chargeur pourra fournir des impulsions de courant pour
desulfater la batterie. De plus, notre chargeur pourra fonctionner en mode d’entretien.
CHARGE A COURANT CONSTANT
CHARGE A TENSION CONSTANTE

5
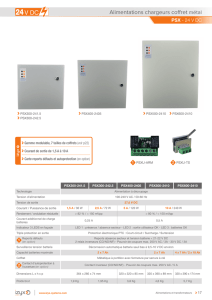
3. LE CAHIER DES CHARGES :
Nous allons réaliser dans un premier temps, un chargeur avec un PIC 16F877 qui est relativement
limité (2 PWM, 8 entrée analogique) mais que nous connaissons bien car on l’utilise dans plusieurs de
nos modules. Puis, nous réaliserons un chargeur avec un PIC 18F6520 qui a 5 PWM, 16 entrées
analogiques).
3.1. CHARGEUR 2x12V/20A AVEC PIC 16F877 :
Le courant de charge sera réglable 2A à 20A et la tension de seuil aussi. Celle-ci variera de 12 V à 16
V. Par sécurité, on limitera le temps de charge à un nombre d’heures programmés.
Le courant et la tension de saturation seront choisis, puis il faudra appuyer sur le bouton poussoir
ON/OFF pour commander la charge. On peut voir sur la figure suivante comment sera organisé
l’afficheur LCD. La consigne a paramétré clignotera. Avant de charger, la tension des 2 batteries
seront mesurées pour diagnostiquer une décharge profonde ou un disfonctionnement.
3. Figure : consigne du chargeur sur l’écran LCD
La fin de la charge sera pour un courant de 10% du courant consigne, mais la tension de sortie sera
toujours mesurée, si celle-ci diminue à 13V alors le chargeur recommencera à charger (cette tension
s’appelle Voltage Floating) avec un courant de consigne divisé par 2 (charge d’entretien).
On peut voir sur la figure suivante l’affichage pendant la charge avec le courant, la tension, le rapport
cyclique, la température, la capacité énergétique et le temps de charge.
4. Figure :
Caractéristique
de la charge : écran LCD
Avec un PIC16F877, Il faudra 2 chargeurs pour charger 4 batteries car il n’a que deux sorties PWM, il
serait intéressant d’avoir un seul processeur et un seul afficheur.
Nous avons choisi un PIC18F6520 car il a 5 PWM 11 convertisseurs Analogiques Numériques.
Rapport cyclique de U1 U1 seuil Consigne de courant I1
Temps de charge max
Température
Transistor et interne
Température transistor et
interne Temps de charge
Rapport cyclique
Tension reel Courant de charge
U1 et U2 mesure
Capacite energetique
BP ON/OFF
BP INCrementer
BP DECrementer
BP SELECT consigne
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
1
/
42
100%