Solidification et fusion de l'eau : Cours de sciences physiques

Chapitre VI Solidification et fusion de l’eau
I] Transformation de l’eau liquide en eau solide par refroidissement ( p. 167 )
1. Définition
La transformation de l’eau liquide en eau solide est la solidification de l’eau.
2. TP
TP n°15 : Solidification de l’eau pure
But du TP :
- Tracer un graphique représentant l’évolution de la température en fonction
du temps, lors de la solidification de l’eau.
Principe Schéma de l’expérience
On mesure la température de l’eau toutes
les 2 minutes. Pour refroidir l’eau, on utilise
un mélange réfrigérant d’eau et de sel.
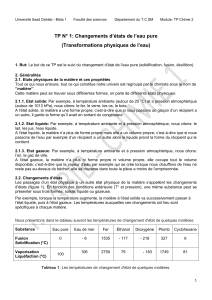
Tableau de mesures
Temps en
minutes (min) 012345678910
Température de
l’eau en degrés
Celsius (°C)
12 5 2,2 1 0,3 0 0 0 -0,2 -1,7 -4
Etats de l’eau
Thermomètre Tube à essais
Mélange réfrigérant
d’eau et de sel
Eau
Bécher

Construction du graphique (horiz : 1cm 1 min vertic. 1cm 2°C )
Commentaires du graphique
Nous constatons que la courbe peut se découper en 3 zones :
1ère zone : de 0 min à 5 min
La température de l’eau diminue de 12 °C à 0 °C .
L’eau existe uniquement à l’état liquide .
2 ème
zone : de 5 min à 7 min
La température de l’eau reste constante à 0 °C .
Sur le graphique, on observe à 0°C un palier de température.
Donc, on en déduit que l’eau utilisée était pure.
Température ( °C )
Temps ( min )
0 1 2 3 4 5 6 7 8 9 10 11 12 13
12
10
8
6
4
2
0
-2
-4
-6

L’eau liquide est en train de devenir solide : l’eau existe sous 2 états liquide et solide .
La solidification a duré 2min : elle a commencé à la 5ème min et s’est terminée à la 7ème min.
Au point S, dans le tube à essais, apparaît le premier cristal de glace et au point L,
disparaît la dernière goutte de liquide.
.
La température 0°C est appelée température de solidification de l’eau pure.
3 ème
zone : après 7 min
La température de l’eau diminue de 0 °C à - 4 °C.
L’eau existe uniquement à l’état solide.
Conclusions du TP de la solidification de l’eau
La solidification d’un corps pur se déroule toujours à une température constante.
Chaque corps pur différent possède sa propre température de solidification : il n’y a que
l’eau pure qui se solidifie à 0°C.
Exemples de température de solidification pour d’autres corps purs
L’éthanol pur se solidifie à -120 °C.
La glycérine se solidifie à 18,2 °C.
3.Exercices
Correction des deux exercices de la feuille
Ex.1
a) L’axe vertical représente la température en °C et l’axe horizontal le temps en minutes.
b) Dans la zone 1, la température augmente. Dans la zone 2, la température reste
constante.
c) Dans la zone 1, l’eau est liquide. Dans la zone 2, elle est liquide et vapeur.
d) L’eau bout à 100°C à la pression atmosphérique normale car on observe à 100°C un palier
de température sur la courbe.
Ex.2
a) Au début de l’expérience, la température diminue, puis reste constante et diminue à
nouveau en fin de TP.

b) Entre 4 et 6 min, a lieu la solidification de l’eau.
c) Au bout de 7 min, l’eau est solide car sa température est inférieure à 0°C.
II] Transformation de l’eau solide en eau liquide par réchauffement
1. Définition
La transformation de l’eau solide en eau liquide est la fusion de l’eau.
2. Activité
Questions
1) Comment varie la température de l’eau du tube à essais entre le début et la fin de
l’expérience ?
2) Comment varie la température de l’eau du bécher entre le début et la fin de
l’expérience ?
3) Quelle est la température initiale de l’eau dans le tube à essais ? Quel est l’état de l’eau
au début de l’expérience ?
4) Quelle est la température finale de l’eau dans le tube à essais ? Quel est l’état de l’eau à
la fin de l’expérience ?
5) Trace sur le graphique ci-dessus deux traits verticaux séparant la courbe en trois
parties.
6) Ajoute sur le graphique les états de l’eau dans les trois parties du graphique.
7) Quel changement d’état a-t-on voulu réaliser dans cette expérience ?
8) Combien de temps a duré le changement d’état ? A quelle température a-t-il eu lieu ?
9) Comment peut-on appeler la température ci-dessus ?
10) Comment voit-on sur le graphique que l’eau utilisée était pure ?
Présentation de l’expérience
On place un tube à essais contenant de la
glace dans un bécher d’eau tiède. On relève
la température de l’eau toutes les minutes.
Tableau de mesures et graphique
S
S
+ L L

1) La température de l’eau du tube à essais a augmenté, puis est restée constante puis a
augmenté à nouveau.
2) La température de l’eau du bécher a diminué : il y a eu transfert d’énergie, sous forme
de chaleur, entre l’eau du bécher et l’eau du tube à essais.
3) La température initiale de l’eau solide est - 2,7°C.
4) La température finale de l’eau liquide est 6,3°C.
7) On a voulu réaliser la fusion de l’eau.
8) La fusion a duré 3 minutes à la température de 0°C.
9) 0°C correspond à la température de fusion de l’eau pure.
10) L’eau utilisée dans le tube à essais était pure car on observe sur le graphique un palier
de température pendant la fusion.
Les températures de fusion et de solidification de l’eau pure sont égales.
 6
6
 7
7
 8
8
1
/
8
100%