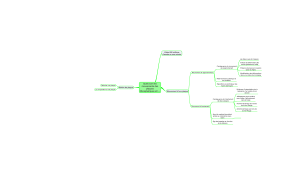
Physiopathologie de la plaque d`athérome vulnérable.

Physiopathologie de la plaque d'athérome vulnérable
198 Médecine Nucléaire - Imagerie fonctionnelle et métabolique - 2005 - vol.29 - n°4
Correspondance : Daniel Fagret
INSERM 0340 Radiopharmaceutiques biocliniques - Faculté de Médecine de Grenoble - 38700 La Tronche
Tel. :04 76 76 89 55 - Fax.:04 76 63 71 42 - E-mail. : Dfagret@chu-grenoble.fr
Physiopathologie de la plaque d’athérome vulnérable.
A. Broisat, L. Riou, D. Fagret,
C. Ghezzi INSERM 0340 Radiopharmaceutiques biocliniques
- Université de Grenoble -
Résumé
Depuis une décennie, notre compréhension de la physiopathologie des évènements coro-
nariens, depuis les aspects histomorphologiques jusqu’aux mécanismes moléculaires conduisant
à la rupture des plaques d’athérome, a fortement évolué et le concept de plaque d’athérome vul-
nérable a émergé. Ces plaques vulnérables sont caractérisées par des phénomènes inflammatoi-
res chroniques ainsi que par une large plage lipidique et nécrotique (> 40% du volume) recou-
verte par une fine capsule fibreuse (< 100 µm). Peu ou pas sténosante, ces plaques ne sont pas
diagnostiquées lors d’une angiographie. Cependant, ce sont elles qui sont responsables de la
majorité des évènements coronariens aigus. Diagnostiquer et stabiliser les plaques d’athérome
vulnérable représente donc un enjeu clinique majeur.
Plaque d'athérome vulnérable / Inflammation chronique / Apoptose / Thrombus
INTRODUCTION
!L’athérosclérose est une pathologie
de la paroi artérielle qui se développe
dès le stade fœtal et évolue ensuite
lentement durant plusieurs décen-
nies pour ne devenir généralement
symptomatique qu’à la fin de l’âge
adulte. Ainsi, dans les pays industria-
lisés, la plupart des individus adultes
vivent avec des lésions athéroscléroti-
ques coronaires asymptomatiques.
Durant la dernière décennie, de nom-
breuses études ont considérablement
bouleversé nos connaissances de la
physiopathologie de l’athérosclérose
[1,2]. Ainsi, longtemps considérée
comme une accumulation progres-
sive et sténosante de lipides dans la
paroi artérielle, l’athérosclérose est à
présent considérée comme une pa-
thologie inflammatoire chronique au
sein de laquelle on distingue, en fonc-
tion de leur métabolisme et de leur
composition, différents types de pla-
ques d’athérome [3,4]. Les plaques
sujettes à la rupture, et dont le déve-
loppement n’est pas nécessairement
obstructif, sont responsables de la
majorité des évènements coronariens
aigus [5]. Ce sont donc ces plaques,
dites "plaques vulnérables", qui cons-
tituent actuellement la première ci-
ble pour le diagnostic comme pour
la thérapie de l’athérosclérose [6].

A. Broisat, L. Riou, D. Fagret, C. Ghezzi
Médecine Nucléaire - Imagerie fonctionnelle et métabolique - 2005 - vol.29 - n°4 199
LES ÉVÈNEMENTS INITIAUX
AU DÉVELOPPEMENT DE
L’ATHÉROSCLÉROSE
La dysfonction endothéliale
!L’athérosclérose est une pathologie
inflammatoire chronique de la paroi
artérielle [1]. Elle se développe de
manière diffuse dans l’ensemble des
grosses artères à des sites privilégiés.
En effet, les lésions athérosclérotiques
apparaissent principalement au ni-
veau des bifurcations artérielles, sur
la paroi opposée au point de jonc-
tion. A ce niveau, les forces de cisaille-
ment très basses et oscillantes
(± 4.10-1 N.m-2 (+ 4 dynes/cm2))) sont
responsables de nombreuses modi-
fications dans l’expression génique,
le métabolisme et la morphologie
des cellules endothéliales qui prédis-
posent l’endothélium à l’inflamma-
tion en augmentant sa perméabilité
aux lipides ainsi que le recrutement
des leucocytes circulants.
Le rôle des lipoprotéines
de basse densité dans
l’athérosclérose
!Parmi les nombreux facteurs de ris-
que génétiques et environnementaux
impliqués dans l’athérosclérose, l’élé-
vation du taux de cholestérol est le
seul à pouvoir induire le développe-
ment de la plaque, même en l’absence
de cofacteurs [7]. La compréhension
des mécanismes moléculaires qui
contrôlent la synthèse et les taux plas-
matiques de cholestérol a permis le
développement d’une classe de mé-
dicaments hypocholestérolémiants,
les statines. Elles réduisent significa-
tive-ment les risques de mortalité liés
aux pathologies cardiovasculaires
chez des patients hypercholestéro-
lémiques, confirmant ainsi le rôle
prépondérant du cholestérol. Dans le
plasma, le cholestérol est transporté
par différentes lipoprotéines. Ce sont
les lipoprotéines de basse densité ou
Low Density Lipoproteins (LDL) qui
sont responsables sous leur forme
oxydée (LDLox) de l’initiation de l’in-
flammation lors de l’athérosclérose.
RÔLE DES MACROPHAGES
!En conditions normales, le recrute-
ment de monocytes au sein de la pa-
roi artérielle et leur différenciation en
macrophages est un phénomène pro-
tecteur qui permet l’élimination des
particules de LDL oxydées cytotoxi-
ques et pro-inflammatoires et des
cellules apoptotiques. Le recrutement
de ces monocytes est régulé par la
production de molécules chémo-
attractrices telles que la "Macrophage
Chemotactic Protein 1" (MCP-1) et
l’interleukine 8 (IL-8) et par des mo-
lécules d’adhésion endothéliales : E
et P-sélectines et immunoglobulines
(ICAM-1, VCAM-1, PECAM). L’expres-
sion de ces molécules aux sites de
dysfonction endothéliales et/ou en
présence de LDLox est responsable
de l’accumulation des macrophages
dans l’espace sous-endothélial lors de
l’athérogénèse [7,8,9]. L’accumulation
massive de cholestérol au sein de ces
macrophages aboutit à la formation
de cellules spumeuses. Les LDL nati-
ves ne peuvent pas induire la forma-
tion des cellules spumeuses car leur
captation par les macrophages est
lente, et parce qu’il existe une régu-
lation négative de leurs récepteurs en
réponse au cholestérol intracellulaire
qui empêche leur accumulation
intracytoplasmique. En revanche, les
LDL acétylées ou oxydées peuvent
induire la formation des cellules spu-
meuses. Leur captation est rapide et
leurs récepteurs ne sont pas régulés
négativement. Ces récepteurs, expri-
més par les macrophages en réponse
au M-CSF sont des récepteurs "Scaven-
ger". Le cholestérol des LDLox est
stocké au sein de lysosomes sous
forme de cholestérol libre. Si sa sor-
tie, essentiellement assurée par les
HDL, n’est pas suffisamment élevée,
le cholestérol libre est ré-estérifié et
s’accumule dans le cytoplasme sous
forme de gouttelettes lipidiques. Ce
sont ces cellules chargées de goutte-
lettes lipidiques que l’on nomme
cellules spumeuses. Les macrophages
et les cellules spumeuses prolifèrent
et sécrètent un grand nombre de fac-
teurs de croissance et de cytokines
qui vont amplifier la réponse inflam-
matoire, permettant ainsi la progres-
sion de l’athérosclérose [9].
LA PROGRESSION DE
L’ATHÉROSCLÉROSE
!Le développement de la plaque
d’athérome est caractérisé par l’am-
plification de la réponse inflamma-
toire. De nouveaux monocytes et des
lymphocytes sont recrutés. Les
macrophages sont des cellules pré-
sentatrices d’antigènes (CPA) capa-
bles d’activer les lymphocytes T re-
crutés en lymphocytes T "helper" 1
et 2 (Th1 et Th2) [1]. Les principaux
antigènes présentés résultent de
l’apprêtement des LDLox captées par
les macrophages. L’interaction entre
les macrophages et les lymphocytes
Th1 et Th2 engendre la production
d’un grand nombre de cytokines pro-
et anti-inflammatoires (interleukines,
interféron γ) qui vont moduler l’in-
flammation et agir sur de nombreu-
ses cellules au sein de la paroi arté-
rielle. Ces molécules vont notam-
ment stimuler la prolifération des
cellules musculaires lisses et leur
migration depuis la média vers l’in-
tima. Ces cellules musculaires lisses
intimales dégradent la matrice extra-
cellulaire afin de pouvoir proliférer
et captent les LDLox, participant ainsi
à la formation des cellules spumeu-
ses. Elles jouent également un rôle
stabilisateur de la plaque par la syn-
thèse de protéines de la matrice
extracellulaire - fibrinogène, colla-
gène et protéoglycanes - qui recou-
vrent la plaque d’athérome d’une cap-
sule fibreuse [1,7]. Par ailleurs, les
lymphocytes T, les cellules endothé-
liales, les macrophages et les cellu-
les musculaires lisses expriment tou-
tes CD40 et CD40L, or l’interaction
cellule-cellule par la liaison de la pro-
téine CD40 avec son récepteur CD40L
joue également un rôle important
dans le développement de la plaque
puisqu’elle induit la synthèse de nom-
breuses molécules pro-athérogéni-
ques. Ces facteurs pro-athérogéniques
incluent des cytokines inflammatoi-
res, des métalloprotéinases (MMPs)
qui dégradent la matrice extra-cellu-
laire et déstabilisent la plaque, et le

Physiopathologie de la plaque d'athérome vulnérable
200 Médecine Nucléaire - Imagerie fonctionnelle et métabolique - 2005 - vol.29 - n°4
facteur tissulaire (TF) pro-throm-
botique. Ainsi, le recrutement et l’ac-
tivation de lymphocytes Th1 et Th2
amplifie l’inflammation et stimule la
prolifération et la migration des cel-
lules musculaires lisses.
DÉSTABILISATION DE
LA PLAQUE D’ATHÉROME
!Les plaques caractérisées par des
phénomènes inflammatoires chroni-
ques et par un large cœur lipidique
et nécrotique mou, recouvert par une
fine capsule fibreuse, sont instables.
Cette instabilité est exacerbée par les
phénomènes inflammatoires qui sti-
mulent les phénomènes apoptoti-
ques et la dégradation de la matrice
extracellulaire.
Apoptose
!Les plaques d’athérome peuvent
être le siège d’intenses processus
apoptotiques. L’apoptose survient au
niveau de tous les types cellulaires.
Ce sont essentiellement les macro-
phages et les lymphocytes T qui sont
touchés, mais les cellules endothélia-
les peuvent aussi être affectées. Les
LDL oxydées sont toxiques pour les
cellules spumeuses (macrophages et
cellules musculaires lisses). D’autre
part, les cytokines pro-inflammatoires
peuvent également induire ce proces-
sus par la production excessive de
monoxyde d’azote conduisant à la
formation de radicaux libres de l’oxy-
gène. L’apoptose des macrophages
est fréquemment observée à la base
des plaques en bordure de la plage
lipidique, ce qui suggère que la mort
des macrophages par ce processus
contribue à la croissance de la plage
lipidique dans laquelle les corps
apoptotiques s’accumulent pour for-
mer un corps lipidique et nécrotique
qui déstabilise la plaque. L’apoptose
des cellules musculaires lisses peut
limiter l’extension et la prolifération
intimale de ces cellules, limitant ainsi
le développement sténosant de la
plaque, mais elle va également affai-
blir la plaque en diminuant la syn-
thèse fibreuse qui recouvre et stabi-
lise la plage lipidique et nécrotique
instable. Le degré de la réaction in-
flammatoire détermine en grande
partie le taux de cellules apoptoti-
ques [7]. L’apoptose joue donc un
rôle déterminant dans la fragilisation
de la plaque d’athérome mais égale-
ment dans la formation du thrombus.
En effet, non seulement l’apoptose
fragilise la plaque en réduisant
l’épaisseur de la capsule fibreuse et
en augmentant la taille du corps lipi-
dique et nécrotique mais, de plus, les
corps apoptotiques sont procoagu-
lants. Le phénomène d’apoptose joue
donc un rôle déterminant dans l’évo-
lution de la plaque d’athérome vers
la plaque à risque.
Les métalloprotéinases
!Les métalloprotéinases (MMP)
secrétées par les macrophages et les
cellules musculaires lisses lors de
leur migration, telles que les colla-
génases, élastases et stromelisines,
jouent également un rôle majeur
dans la déstabilisation de la plaque
en dégradant les protéines de la ma-
trice. Les lymphocytes T activés au
sein de la plaque stimulent la pro-
duction de ces MMP par les macro-
phages. Les MMP favorisent le remo-
delage de la plaque d’athérome, la
migration des cellules inflammatoi-
res et la dégradation de la capsule fi-
breuse qui recouvre et stabilise la
plage lipidique et nécrotique.
La néoangiogénèse
!L’angiogenèse permet la formation
et le développement des vaisseaux.
C’est un processus complexe néces-
sitant l’activation, la prolifération et
la migration des cellules endothélia-
les. Lorsque l’épaisseur de la paroi
artérielle augmente durant le déve-
loppement de la plaque d’athérome,
des néovaisseaux se forment à partir
du vasa vasorum afin d’irriguer le
tissu nouvellement formé. Ces micro-
vaisseaux jouent un rôle dans le dé-
veloppement et la rupture de la pla-
que d’athérome. Ils sont responsables
de micro-hémorragies intraplaques
qui déstabilisent la lésion. Ils partici-
pent également à l’exacerbation de
la réponse inflammatoire en partici-
pant au recrutement de nouveaux
leucocytes. De plus, la présence de
microvaisseaux à la base de la plaque
d’athérome est corrélée à la rupture
indépendamment des facteurs cités
précédemment, ce qui indique que
la néovascularisation contribue en
elle-même au phénomène de désta-
bilisation de la plaque d’athérome.
RUPTURE DE LA PLAQUE ET
FORMATION DU THROMBUS
!Les plaques vulnérables sont donc
sujettes à la rupture. Lorsque celle-ci
se produit, les molécules pro-
thrombotiques contenues dans la pla-
que sont libérées et entrent en con-
tact avec le sang, ce qui induit la for-
mation d’un thrombus susceptible
d’oblitérer la lumière vasculaire et
d’induire une ischémie myocardique,
symptomatique ou non, sur le terri-
toire en aval. Parmi ces molécules, le
facteur tissulaire (TF) est une petite
glycoprotéine exprimée par les cel-
lules endothéliales, les macrophages
et les cellules musculaires lisses de
la plaque. Il se lie au facteur VII/VIIa
dans le sang et initie la cascade de
coagulation [2].
Dans 2/3 des cas, la formation du
thrombus responsable de l’accident
coronaire est due à la rupture ou à la
fissuration d’une plaque d’athérome
vulnérable, tandis que l’érosion d’une
lésion athérosclérotique vulnérable
est responsable du tiers des accidents
restants [10]. Par ailleurs, la plaque
d’athérome n’évolue pas nécessaire-
ment vers la rupture mais peut égale-
ment s’orienter vers un état stable fi-
breux ou calcifié. Une classification
des différents types de plaques a été
établie par l’American Heart Associa-
tion (AHA).

A. Broisat, L. Riou, D. Fagret, C. Ghezzi
Médecine Nucléaire - Imagerie fonctionnelle et métabolique - 2005 - vol.29 - n°4 201
CLASSIFICATION
DES PLAQUES D’ATHÉROME
!La plaque d’athérome est une pa-
thologie évolutive. En fonction du
stade de développement, une classi-
fication des plaques a été établie par
l’AHA [3,4]. Durant les premiers sta-
des de l’athérosclérose, l’évolution de
la pathologie est prédictible et carac-
téristique (I à IV), puis il existe diffé-
rents types de progression résultant
en différents types de lésions.
La lésion initiale de type I contient
suffisamment de LDLox pour induire
le recrutement des premiers macro-
phages et leur évolution en cellules
spumeuses. Ce type de lésion se dé-
veloppe chez l’homme dès le début
de la vie. La lésion de type II, ou strie
lipidique, contient des cellules spu-
meuses issues de macrophages ainsi
que des cellules musculaires char-
gées en lipides. La lésion de type III,
ou pré-athérome, est caractérisée par
la présence de gouttelettes lipidiques
extracellulaires. La lésion de type IV,
ou athérome, est caractérisée par un
large cœur lipidique instable formé
par la fusion des gouttelettes lipidi-
ques des plaques de type III. La lé-
sion de type V résulte du recouvre-
ment de la lésion de type IV par une
capsule fibreuse principalement
constituée de collagène. Lorsque la
plage lipidique demeure importante,
il s’agit d’une lésion de type Va. Si la
plage lipidique se calcifie, il s’agit
d’une lésion de type Vb. Enfin, s’il n’y
pas ou peu de lipides et que le tissu
connectif fibreux prédomine, il s’agit
d’une lésion de type Vc. La lésion de
type VI résulte de la complication
d’une lésion de type IV ou V. Il peut
s’agir d’une rupture, d’un hématome,
d’une hémorragie ou enfin d’une
thrombose.
Les lésions sont considérées comme
étant des « lésions avancées » lorsque
l’accumulation de lipides, cellules et
composants de la matrice induit une
désorganisation et un épaississement
de l’intima. Il s’agit des lésions de
type IV, V et VI. Dans un premier
temps, le développement de ces lé-
sions avancées est excentrique, puis
dans un second temps, elles peuvent
ou non induire un rétrécissement de
la lumière de l’artère, qui peut ou non
permettre leur détection par angiogra-
phie. Les plaques vulnérables sujet-
tes à la rupture sont de type IV et Va.
LA PLAQUE D’ATHÉROME
VULNÉRABLE
!Le terme de plaque d’athérome "vul-
nérable" désigne l’ensemble des pla-
ques susceptibles d’entraîner la for-
mation d’un thrombus ou d’évoluer
très rapidement [6]. Les principaux
critères utilisés pour les distinguer
sont :
- l’inflammation,
- une fine capsule fibreuse (<100 µm)
et un large cœur lipidique et
nécrotique (> 40% du volume de la
plaque),
- des zones de dénudation endothé-
liale avec de l’agrégation plaquettaire
superficielle,
- une fissure de la capsule fibreuse,
- une sténose sévère.
Considérant que l’organisme dans
son entier peut moduler le dévelop-
pement de l’ensemble des plaques
d’athérome, la notion de patient vul-
nérable a également été récemment
introduite. Ainsi, une élévation de fac-
teurs pro-athérogéniques, hyperten-
seurs ou pro-inflammatoires issus de
différents organes et relargués dans
le sang (que l’on nomme alors sang
vulnérable), va précipiter l’évolution
de l’ensemble des plaques d’athé-
rome coronariennes et induire la for-
mation d’un myocarde vulnérable.
Les plaques d’athérome vulnérables
susceptibles de se rompre sont nom-
breuses et leur risque de complica-
tions étant également important, ce
sont elles qui sont responsables de
la majorité des pathologies corona-
riennes. Ainsi, des études cliniques
ont montré que dans 2 infarctus du
myocarde sur 3 on ne retrouve pas
de sténose coronaire > 50% sur la co-
ronaire responsable de l’infarctus [5].
La coronarographie, qui reflète le dia-
mètre de la lumière artérielle, ne per-
met donc pas de visualiser ces pla-
ques vulnérables et la mise au point
d’une nouvelle technique de détec-
tion est un enjeu clinique majeur.
CONCLUSION
!Les récentes avancées réalisées
dans la connaissance de la physiopa-
thologie de l’athérosclérose ont per-
mis de mettre au point des thérapeu-
tiques très efficaces pour traiter les
plaques d’athérome vulnérables. Il
s’agit principalement des statines, des
anti-thrombotiques et des hypoten-
seurs. De plus, de nouveaux pharma-
ceutiques sont à l’étude, incluant les
fibrates et les thiazolidinediones.
Aujourd’hui, le manque se situe donc
au niveau du diagnostic. Il n’existe
en effet aucun outil diagnostique de
la plaque d’athérome vulnérable en-
visageable en pratique clinique. Or
cette pathologie touche un grand
nombre d’individus, et il devient
donc essentiel de pouvoir dépister
efficacement, au sein d’une large po-
pulation, les individus à haut risque.

Physiopathologie de la plaque d'athérome vulnérable
202 Médecine Nucléaire - Imagerie fonctionnelle et métabolique - 2005 - vol.29 - n°4
Physiopathology of the vulnerable atherosclerotic plaque
During the last decade, our knowledge on the coronary events physiopathology, from
histomorphologic aspects to molecular mechanisms leading to the atherosclerotic plaque rupture,
has considerably evolved and the concept of the vulnerable plaque has emerged. These vulnerable
plaques are characterized by chronic inflammatory processes and by a large lipidic and necrotic
core (> 40% of the volume) covered by a thin fibrous cap (< 100 mm). Mildly obstructive or not,
these plaques are not detectable by angiography. However, they are responsible for the majority of
acute coronary events. Then, diagnosis and stabilization of the vulnerable atherosclerotic pla-
ques represent a major clinical challenge.
Vulnerable atherosclerotic plaque / Inflammatory process / Apoptosis / Thrombus
RÉFÉRENCES
1. Ross R. Atherosclerosis – An
inflammatory disease. N Engl J Med
1999;340 :115–26
2. Fuster V, Fayad ZA, Badimon JJ.
Acute coronary syndromes: biology.
Lancet 1999; 353(suppl 2):S115–19
3. Stary H, Chandler AB, Glagov S, Guy-
ton JR, Insull WJr, Rosenfeld ME et
al. A definition of initial, fatty streak,
and intermediate lesions of
atherosclerosis: a report from the
committee on vascular lesions of
the council on atherosclerosis : a
report from the committee on
vascular lesions of the council on
arteriosclerosis, American Heart
Association. Special report. Arterio-
scler Thromb 1994;14:840–56
4. Stary H, Chair C, Bleakley A,
Dinsmore R, Fuster V, Glagov S et
al. A definition of advanced types
of atherosclerotic lesions and a
histological classification of
atherosclerosis: a report from the
committee on vascular lesions of
the council on arteriosclerosis,
American Heart Association. Special
report. Circulation1995;92:1355–74
5. De Franco AC, Nissen SE. Coronary
intravascular ultrasound : implica-
tion for understanding the deve-
lopment and potential regression of
atherosclerosis. Am J Cardiol
2001;88(suppl):7M-20M
6. Naghavi M, Libby P, Falk E,
Casscells SW, Litovsky S, Rumberger
J et al. From vulnerable plaque to
vulnerable patient. A call for new
definitions and risk assessment
strategies: part I. Circulation 2003;
108:1664–72
7. Glass CK, Witztum JL. Athero-
sclerosis : the road ahead. Cell 2001;
104:503–16
8. Malek A, Alper S, Izumo S. Hemo-
dynamic shear stress and its role
in atherosclerosis. J Am Med Ass
1999;282:2035–42
9. Libby P. Inflammation in
atherosclerosis. Nature 2002;420:
868–74
10. Madjid M, Zarrabi A, Litovsky S,
Willerson JT, Casscells W. Finding
vulnerable atherosclerotic plaques.
Is it worth the effort ? Arterioscler
Thromb Vasc Biol. 2004;24:1775-82
1
/
5
100%