La réponse inflammatoire et ses marqueurs

1/38
UE2 – Biopathologie
J.J. Hoarau
Date : 25/09/2015 Plage horaire : 14h-16h
Promo : DFGSM2 2015-2016 Enseignant : J.J. HAORAU
Ronéistes :
CHUN HUNG KEE Jade
GRUSON Kadoline
La réponse inflammatoire et ses marqueurs
I. Les médiateurs de l’inflammation
1. Les médiateurs plasmatiques
A.Système complément
B.Le système des kinines
C.Facteurs de la coagulation/fibrinolyse
2.Les médiateurs cellulaires
A.Médiateurs préformés
B.Les médiateurs néoformés

2/38
II. Les marqueurs de l’inflammation
1. La vitesse de sédimentation (VS)
2. Les marqueurs plasmatiques
A.Amplitude de variation
B.Cinétique de variation
3. Caractéristiques des principaux marqueurs utilisés en MedG
A.La CRP
B.L’haptoglobine
C.La fraction C3 du complément
D.Pro calcitonine
E.Hémogramme (NFS) et inflammation
F.Electrophorèse des protéines sériques
4. Le choix des marqueurs

3/38
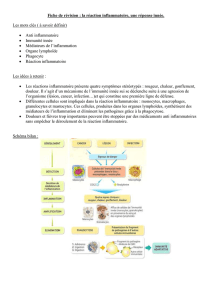
Afin de suivre une réponse inflammatoire on s’intéresse, au niveau clinique, à ce que l’on appelle
les marqueurs de l’inflammation qui dérivent en fait des médiateurs de l’inflammation. Pour savoir
quels marqueurs seraient utiles en termes de diagnostic, il est nécessaire de savoir quels sont les
différents types de médiateurs qui sont conduits, libérés et qui pourraient être utiles. Cependant toutes
ces molécules ne sont pas utilisables en clinique mais plutôt en recherche ou dans d’autres domaines…
I. Les médiateurs de l’inflammation
Les médiateurs de l’inflammation sont essentiellement des médiateurs chimiques qui seront produits,
synthétisés, libérés. Ce sont toutes les molécules qui sont produites par les cellules spécialisées ou
non, au cours de la réaction inflammatoire.
Ils sont nombreux et de diverses natures. On les retrouve à deux niveaux :
- Local : Médiateurs produits au niveau cellulaire, au niveau du site de l’inflammation lui-même,
soit par les cellules qui ont infiltré le tissus et impliquées dans la réponse immunitaire, soit par
les cellules résidentes du tissus et les cellules nécrosées ayant subi l’agression.
- Systémique : Médiateurs produits à distance du site: on les retrouve au niveau du plasma. Ils sont
dits circulants et circulent sous forme inactivée, sous forme de précurseurs qui devront être
activés lorsqu’ils arriveront sur le site de l’inflammation (ces médiateurs, au cours de la phase
vasculo-exsudative, vont traverser l’endothélium vasculaire et infiltrer le tissu). Les marqueurs
de l’inflammation sont surtout d’origine sérique, retrouvés au niveau de la circulation sanguine
et sont majoritairement produits par le foie.
Certains sont présentés sur le schéma ci-dessus.

4/38
On en verra 2 très importants produits par le foie (systémiques):
- Les facteurs du complément qui interviennent dans les mécanismes de défense naturelle,
l’immunité innée, tels que les anaphylatoxines qui ont un pouvoir chémorétractant pour les
cellules du système immunitaire ; on retrouve d’autres facteurs dont l’ensemble peut contribuer à
la formation de complexes d’attaque membranaire qui participent à la destruction des agents
pathogènes. (lysent les cellules)
- Le facteur XII, participe au mécanisme de la coagulation et de la fibrinolyse, et au système des
kinines.
La plupart des médiateurs de l’inflammation utilisés en clinique sont d’origine plasmatique (facilement
dosables). Cela serait plus difficile d’avoir accès à l’histamine ou la sérotonine, qui sont produits
localement car il faudrait ponctionner le tissu
Les médiateurs d’origine cellulaires,
- sont soit préformés (histamine, sérotonine, enzymes) stockés dans les granules cytoplasmiques
des cellules (mastocytes (monocytes, macrphages)), basophiles, polymorphonucléaires
(PMN) , neutrophiles, macrophages, plaquettes).
- Une autre partie des constituants (non pré stockés) vont nécessiter une néo synthèse et vont être
libérés (prostaglandines, leucotriènes (prolongent la réaction inflammatoire), espèces oxygénées
et nitrées (lutte anti-infectieuse), facteurs d’agrégation plaquettaires PAF) principalement par les
leucocytes.
Nous allons voir la nature de ces différents médiateurs et dans quels mécanismes ils interviennent…
1. Les médiateurs plasmatiques

5/38
Les médiateurs d’origine plasmatique appartiennent à 3 (voire 4) grands groupes :
- Les facteurs du complément. (ensemble de protéines circulant sous forme inactive, et qui
s’activent une fois recrutés sur le foyer inflammatoire) ex : facteurs C5a et C3a qui sont des
anaphylatoxines
- Le système des kinines : on y retrouve la bradykinine, vasodilatateur qui agit sur les nerfs
nocicepteurs (->douleur), les médiateurs agissant sur l’endothélium vasculaire (-
>hypotension). La production de ces composés est activée lorsque le facteur XII de la
coagulation (médiateur plasmatique) est apporté par la circulation sanguine. Lorsqu’il traverse
l’endothélium vasculaire, il va s’activer et entraîner la synthèse de bradykinine à partir de la
prékallikréine.
- Le système impliqué dans la coagulation et la fibrinolyse, qui à partir de composés plasmatiques
va permettre la coagulation avec la thrombine, la prothrombine, ou l’inverse va permettre la
fibrinolyse en apportant du plasminogène par exemple ; le facteur XII a aussi son rôle à jouer
dans ce système. La fibrine est formée à partir du fibrinogène. Le mécanisme inverse de la
coagulation est la fibrinolyse.
A. Système complément
Le système du complément est un ensemble de protéines plasmatiques - environ une vingtaine -
synthétisées par les cellules spécifiques et non spécifiques du système immunitaire. Les facteurs du
complément sont reconnaissables par leur nomenclature « lettre C + un numéro », de C1 à C9.
Cet ensemble de protéines plasmatiques ont un système d’activation en cascade intervenant dans les
mécanismes de défense de l’immunité innée.
Il existe 3 voies d’activation du système du complément :
- La voie classique : la seule voie qui puisse être activée à partir d’un complexe immun.
(complexe Ag-Ac) Au cours d’une réaction inflammatoire d’origine infectieuse, elle est initiée
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
1
/
46
100%