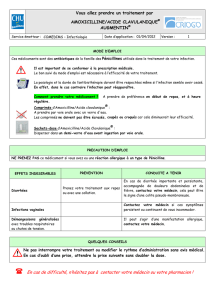
Amoxibactin 250 mg : Notice vétérinaire pour chiens

Bijsluiter – FR Versie AMOXIBACTIN 250 MG
NOTICE
Amoxibactin 250 mg comprimés pour chiens
1. NOM ET ADRESSE DU TITULAIRE DE L’AUTORISATION DE MISE SUR LE
MARCHÉ ET DU TITULAIRE DE L’AUTORISATION DE FABRICATION
RESPONSABLE DE LA LIBÉRATION DES LOTS, SI DIFFÉRENT
Titulaire de l’autorisation de mise sur le marché :
Le Vet. Beheer B.V.
Wilgenweg 7
3421 TV Oudewater
Pays-Bas
Fabricant responsable de la libération des lots :
Lelypharma B.V.
Zuiveringweg 42
4283 PZ Lelystad
Pays-Bas
2. DÉNOMINATION DU MÉDICAMENT VÉTÉRINAIRE
Amoxibactin 250 mg comprimés pour chiens
Amoxicilline
3. LISTE DE LA (DES) SUBSTANCE(S) ACTIVE(S) ET AUTRE(S) INGRÉDIENT(S)
1 comprimé contient :
Substance active :
Amoxicilline 250 mg (correspondant à 287,50 mg de trihydrate d’amoxicilline)
Comprimé blanc à blanc cassé tacheté de brun, rond et convexe, aromatisé, avec une barre de cassure
en croix sur une face. Les comprimés peuvent être divisés en deux ou quatre doses égales.
4. INDICATION(S)
Traitement des infections primaires et secondaires des voies respiratoires, telles que la rhinite due à
Pasteurella spp. et Streptococcus spp. et la bronchopneumonie due à Pasteurella spp.,
Escherichia coli et aux cocci à Gram positif.
Traitement des infections primaires des voies urogénitales, telles que la pyélonéphrite et les infections
urinaires basses dues à Escherichia coli, Proteus spp. et aux cocci à Gram positif, l’endométrite due à
Escherichia coli, Streptococcus canis et Proteus spp. et la vaginite consécutive à des infections
mixtes.
Traitement de la mammite (inflammation de la glande mammaire) due aux cocci à Gram positif et à
Escherichia coli.
Traitement des infections cutanées localisées dues à Streptococcus spp.
5. CONTRE-INDICATIONS
Ne pas utiliser en cas d’hypersensibilité aux pénicillines ou à d’autres substances de la famille des β-
lactamines (par exemple céphalosporines) ou à l’un des excipients.
Ne pas utiliser chez les gerbilles, cobayes, hamsters, lapins et chinchillas.
Ne pas utiliser chez les animaux présentant un dysfonctionnement rénal grave accompagné d’anurie
ou d’oligurie (pas, ou très faible production d'urine).

Bijsluiter – FR Versie AMOXIBACTIN 250 MG
6. EFFETS INDÉSIRABLES
Des symptômes gastro-intestinaux légers (diarrhée et vomissements) peuvent se produire après
l’administration du produit.
Des réactions d’hypersensibilité (réactions allergiques cutanées, anaphylaxie) peuvent survenir
occasionnellement. Dans ce cas, l’administration doit être interrompue et un traitement
symptomatique doit être administré.
Si vous constatez des effets indésirables graves ou d’autres effets ne figurant pas sur cette notice,
veuillez en informer votre vétérinaire.
7. ESPÈCE(S) CIBLE(S)
Chiens
8. POSOLOGIE POUR CHAQUE ESPÈCE, VOIE(S) ET MODE D’ADMINISTRATION
Administration par voie orale chez le chien.
Afin de s’assurer que la posologie est correcte et d’éviter tout sous-dosage, la masse corporelle de
l’animal doit être déterminée aussi précisément que possible.
Posologie
La dose recommandée est de 10 mg d’amoxicilline par kg de masse corporelle, deux fois par jour
pendant un minimum de 5 jours consécutifs. Dans la majorité des cas courants, l’infection répond à
un traitement de 5 à 7 jours. Si aucune amélioration n’est observée après 5 à 7 jours, le diagnostic doit
être réévalué. En cas d’infection chronique ou réfractaire, un traitement plus long peut être nécessaire.
Le tableau ci-dessous indique les quantités de produit à administrer à la dose standard de 10 mg par
kg de masse corporelle deux fois par jour.
Nombre de comprimés, deux fois par jour
Masse corporelle
(kg)
Amoxicilline 50 mg
pour les chiens et
les chats
Amoxicilline 250 mg
pour les chiens
Amoxicilline 500 mg
pour les chiens
1 – 1,25
> 1,25 – 2,5
> 2,5 – 3,75
> 3,75 – 5
> 5 – 6,25 ou
> 6,25 – 12,5 ou
> 12,5 – 18,75
> 18,75 - 25 ou
> 25 – 31,25
> 31,25 – 37,5 ou
> 37,5 - 50 ou
> 50 – 62,5
> 62,5 - 75

Bijsluiter – FR Versie AMOXIBACTIN 250 MG
= ¼ de comprimé = ½ comprimé = ¾ de comprimé = 1 comprimé
9. CONSEILS POUR UNE ADMINISTRATION CORRECTE
Les comprimés peuvent être divisés en deux ou quatre doses égales pour s’assurer d’une posologie
exacte. Placez le comprimé sur une surface plate, avec la face portant la barre de cassure tournée vers
le haut et la face convexe (arrondie) tournée vers le plan de travail.
Deux demi-doses égales : appuyez avec vos pouces des deux côtés du comprimé.
Quatre quarts de dose égaux : appuyez avec votre pouce au centre du comprimé.
10. TEMPS D’ATTENTE
Sans objet.
11. CONDITIONS PARTICULIÈRES DE CONSERVATION
Tenir hors de la vue et de la portée des enfants.
À conserver à une température ne dépassant pas 30 °C.
Toute portion de comprimés non utilisés doivent être retournés à la plaquette ouverte et utilisé dans
les 4 jours
Ne pas utiliser ce médicament vétérinaire après la date de péremption figurant sur l’étiquette après
EXP. La date de péremption correspond au dernier jour du mois indiqué.
12. MISE(S) EN GARDE PARTICULIÈRE(S)
Précautions particulières d’utilisation chez l’animal :
Chez les animaux présentant un dysfonctionnement hépatique et rénal, le schéma posologique doit
être soigneusement évalué et l’utilisation du produit doit reposer sur une évaluation du rapport
bénéfice/risque par le vétérinaire.
Une prudence particulière est conseillée en cas d’utilisation chez de petits herbivores autres que ceux
mentionnés dans la rubrique 5.
En raison de la probable variabilité (temporelle et géographique) de survenue des résistances
bactériennes à l’amoxicilline, un échantillonnage bactériologique et un test de sensibilité sont
recommandés.
Dans la mesure du possible, le produit devra être utilisé uniquement sur la base d’un test de
sensibilité.
L’utilisation du produit en contradiction avec les instructions fournies dans cette notice pourrait
augmenter la prévalence des bactéries résistantes à l’amoxicilline et réduire l’efficacité du traitement
par d’autres antibiotiques de la famille des bêta-lactamines ou par d’autres classes d’antibiotiques en
raison du risque de résistance croisée.
Les politiques officielles, nationales et régionales, en matière d’utilisation des antibiotiques doivent
être prises en compte lorsque le produit est utilisé.
Bijsluiter – FR Versie AMOXIBACTIN 250 MG
Précautions particulières à prendre par la personne qui administre le médicament aux animaux
Les pénicillines et les céphalosporines peuvent provoquer une hypersensibilité (allergie) après
injection, inhalation, ingestion ou contact cutané. L’hypersensibilité aux pénicillines peut entraîner
des réactions croisées aux céphalosporines et inversement. Les réactions allergiques à ces substances
peuvent occasionnellement être graves.
Ne manipulez pas ce produit si vous savez y être sensibilisé(e) ou s’il vous a été conseillé de ne pas
travailler avec ce type de préparations.
Manipulez ce produit avec un soin extrême afin d’éviter toute exposition, en prenant toutes les
précautions recommandées.
Si vous développez des symptômes après exposition, tels qu’une éruption cutanée, consultez un
médecin et montrez-lui cette mise en garde. Le gonflement du visage, des lèvres ou des yeux ou les
difficultés à respirer constituent des symptômes plus graves et nécessitent une prise en charge
médicale urgente.
Lavez-vous les mains après avoir manipulé les comprimés.
Utilisation en cas de gravidité et/ou de lactation
À ce jour, les études de laboratoire sur les animaux n’ont pas mis en évidence d’effets tératogènes,
fœtotoxiques ou maternotoxiques. Cependant, étant donné qu’aucune étude n’a été réalisée chez les
chiennes en cours de gravidité ou de lactation, il est recommandé de n’utiliser le produit qu’après
évaluation du rapport bénéfice/risque établi par le vétérinaire.
Interactions médicamenteuses ou autres formes d’interactions
Le chloramphénicol, les macrolides, les sulfamides et les tétracyclines peuvent inhiber l’effet
antibactérien des pénicillines en raison de l’apparition rapide de leur action bactériostatique. Le risque
de réaction allergique croisée avec d’autres pénicillines doit être pris en compte.
Les pénicillines peuvent amplifier les effets des aminosides.
Surdosage (symptômes, conduite d’urgence, antidotes)
En cas surdosage, aucun effet indésirable autre que ceux décrits dans la rubrique 6 n’a été identifié.
13. PRÉCAUTIONS PARTICULIÈRES POUR L’ÉLIMINATION DES MÉDICAMENTS
VÉTÉRINAIRES NON UTILISÉS OU DES DÉCHETS DÉRIVÉS DE CES
MÉDICAMENTS, LE CAS ÉCHÉANT
Tous les médicaments vétérinaires non utilisés ou déchets dérivés de ces médicaments doivent être
éliminés conformément aux exigences locales.
14. DATE DE LA DERNIÈRE NOTICE APPROUVÉE
Décembre 2015
15. INFORMATIONS SUPPLÉMENTAIRES
Boîte en carton contenant 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 25 ou 50 plaquette(s) de 10 comprimés
Boîte en carton comprenant 10 boîtes en carton distinctes contenant chacune 1 plaquette de
10 comprimés
Toutes les présentations peuvent ne pas être commercialisées.
Comprimés sécables
BE-V483697

Bijsluiter – FR Versie AMOXIBACTIN 250 MG
A ne délivrer que sur ordonnance vétérinaire
1
/
5
100%