reponse et memoire t cd8

REPONSE ET
MEMOIRE T CD8
Par Eva et Fred
1

Introduction
La réponse LT CD8 permet de lutter contre les organismes intracellulaires ( les virus, certaines
bactéries... ) ainsi que contre les cellules tumorales. Dans le cadre de ce cours, nous prendrons
comme exemple la réponse antivirale. Ce modèle peut s'appliquer aussi aux bactéries et aux
tumeurs.
Rappel sur les virus :
Ce sont dans parasites intracellulaires obligatoires. En effet, ils dépendent de la cellule hôte pour se
multiplier. Ils sont composés d'acides nucléiques (virus à ADN ou ARN), de protéines, ils peuvent
être enveloppés ou non. Ils possèdent également différents niveaux de complexités pouvant aller de
l'expression de 7 à plus de 100 protéines. Le virus pénètre dans la cellule hôte grâce à des récepteurs
(notion de tropisme). Ainsi les cellules sont perméables aux virus seulement si elles possèdent les
récepteurs en question (=cellule permissive). Ils peuvent entrainer des infections locales ou
systémique et une virémie primaire ou secondaire.
Certains mécanismes sont mis en jeu pour permettre au système immunitaire de voir les virus
malgré le fait qu'ils soient intracellulaires.
Il existe de nombreuses infections pour lesquelles il est nécessaire de comprendre l'immunité
antivirale (et notamment la réponse LT8) dans le but de mettre en place de nouvelles stratégies
thérapeutiques : le SIDA, la grippe aviaire, le SRAS (syndrome respiratoire aigu sévère)...
Différents types de réponses antivirales :
–Réponses innées hors système immunitaire :
Défenses antivirales cellulaires : ce sont les défenses intrinsèques à la cellule (par exemple
l'interférence ARN, la voie de la PKR, les facteurs de restriction…)
Les signaux de dangers, qui alertent le système immunitaire : synthèse de cytokines, IFN de type I
(α et β), expression de ligand à la surface de la cellule infectée...
–Le système immunitaire inné :
On a l'action de cytokines (INF de type I, INF γ (INF de type II) synthétisé par les macrophages, IL-
12, IL-18, IL-15...), des cellules NK (qui vont lyser les cellules infectées mais qui vont différer des
LT8 par leur mécanisme de reconnaissance de la cible et par le fait que pour les NK il n'y a pas de
mémoire immunitaire) et des cellules dendritiques qui font le lien entre l'immunité innée et
l'immunité adaptative.
–Le système immunitaire adaptatif :
Il met en jeu des LB (qui entrainent la synthèse d'anticorps neutralisants ou facilitant, puis
mécanisme de l'ADCC), les LT4 (aide à la mise en place et à la maturation des réponses
lymphocytaires T CD8 et B) et les LT8 (différenciation en LT cytotoxique, reconnaissance et lyse
des cellules infectées, inhibition de la réplication virale). A l'inverse des LT8, les cellules NK n'ont
pas besoin d'être activées pour être efficace.
2

Cinétique d'une réponse immunitaire antivirale (en cas de
primo infection) :
Le titre viral augmente dans les 2 premiers jours suivant l'infection. On a d'abord le relargage de
cytokines, puis l'action de cellules NK tueuses, puis l'action de cellules T tueuses (LT8) ainsi que
des anticorps.
La réponse LT8 est nécessaire mais pas suffisante. En effet, elle doit être accompagnée d'une
réponse innée et d'une réponse anticorps pour que la réponse antivirale soit correcte.
I Apprêtement des antigènes viraux par les
cellules dendritiques
Schéma général de l'induction d'une réponse T CD8 antivirale :
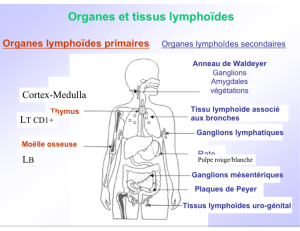
Les LT8 naissent dans la moelle osseuse. Les TCR des LT8 sont obtenus par réarrangement génique
aléatoire, on obtient donc un répertoire aléatoire. Ils vont ensuite dans le thymus où on a une
sélection :
–certains vont être éliminés car ils sont incapables de reconnaître le CMH de l'individu avec
un peptide => sélection positive
–dans ceux qui ont reçu un signal de survie certains vont être éliminés car ils sont auto-
réactifs => sélection négative pour permettre la tolérance au soi
Ils sont ensuite dispersés dans l'organisme (au niveau des organes lymphoïdes secondaires) à l'état
naïf (ils ne sont pas encore capables de tuer une cellule infectée). Le LT8 va d'abord être activé par
une cellule présentatrice de l'antigène (dendritique) grâce au peptide viral présenté par CMH1. Une
fois activé, il y a multiplication de ce LT 8 et il donne naissance à un clone de cellules (cellules
identiques et différenciées). La prolifération et la différenciation est dépendante de IL2 (autocrine
ou sécrété par les TCD4). Les LT8 effecteurs obtiennent alors le permis de tuer (=prérequis) et
peuvent se diriger dans le tissu infecté => élimination de la cellule cible
3

Les LT CD8 naïfs doivent être activés :
Lors de l'interaction entre le complexe CMH-peptide et le TCR, on peut observer une anergie des
CD8 si la cellule dendritique n'avait pas été activé précédemment. En effet, dans ce cas là, il n'y
aura pas de deuxième signal (signal de survie) et le CD8 deviendra inefficace (mécanisme de
protection du soi).
NB : la réponse adaptative nécessite un certain délais (détection par les cellules dendritiques,
présentation de l'antigène, activation lymphocytaire puis élimination de la cible).
Les LT CD8 reconnaissent l'antigène, non pas sous forme native mais sous forme de peptide
antigénique de 8 à 10 acides aminés présenté par les molécules CMH de classe I.
Rappel : on distingue de type de CMH : les CMH I qui sont reconnu par les LT8 et les CMH II qui
sont reconnus par les LT4.
Les CMH I sont formés d'une chaine α ( α1 + α2 + α3) et de la β2 microglobuline.
La poche qui lie le peptide antigénique est constituée de 2 domaines α ( α1 et α2) ainsi que d'un
domaine β. On a donc successivement : une hélice α formée par α1 puis un planché β apporté par α1
et α2 puis une autre hélice α apportée par α2. On voit donc que α3 ne participe pas à la formation
de la poche.
C'est l'ensemble CMH I + peptide qui est reconnu par le TCR.
4

Les LT naïfs sont activés par les cellules dendritiques :
Toutes les cellules nucléées peuvent présenter un peptide via le CMH I mais seules les cellules
dendritiques savent activer les LT naïfs. Le phénotype immature d'une dendritique est la pauvreté en
molécules du CMH1 et 2 ainsi que des molécules de co-stimulation.
Certaines dendritiques migrent en permanence dans les ganglions pour présenter des peptides du soi
et maintenir une tolérance périphérique. La majorité des cellules dendritiques jouent un rôle de
sentinelles dans les tissus périphériques. Elles brassent le milieu qui les entoure, font beaucoup de
pinocytose dans le but de capturer un antigène, cherchent les signaux de danger. Si elles détecte un
danger, elles vont migrer dans la zone T des organes lymphoïdes secondaires. Elles s'activent selon
la nature des signaux de danger détectés (selon la localisation, l'intensité...du signal) : c'est le
processus de maturation des cellules dendritiques. Dans les zones T, la cellule dendritique se
transforme et peut ensuite activer les LT.
Présentation de complexe CMH I – peptides viraux par les
cellules dendritiques :
2 cas de figure selon le tropisme du virus
−soit les cellules dendritiques sont infectées elles même par le virus. Alors elles
synthétisent des protéines virales et les présentent par les CMH I.
−soit les cellules dendritiques ne sont pas infectées par le virus. Dans ce cas, la cellule
dendritique ne synthétise par les protéines virales. Cependant, on remarque que les
antigènes viraux sont quand même présentés via les CMH I. Ceci ce fait grâce au
mécanisme de la Cross-présentation (présentation croisée).
Nous allons voir ces cas plus précisément.
Cas 1 : Présentation des complexes CMH I-peptides viraux par des CD infectées
Le complexe CMH I – peptide est formé à partir des protéines virales synthétisées dans le
cytoplasme par les cellules dendritiques. Ces protéines virales sont marquées avec de l'Ubiquitine,
ce qui entraine leur dégradation par le protéasome (complexe enzymatique multicatalytique qui
possède des protéases qui vont dégrader les protéines en peptides).
NB : suite à l'activation par l'INF type I, certaines sous unité du protéasome vont être échangées, ce
qui permet la formation d'un immuno-protéasome plus efficace pour synthétiser une quantité de
peptides plus importante et plus appropriés pour la présentation par les CMH I.
Après cette dégradation protéolytique des peptides, ces derniers se retrouves dans le cytosol et
doivent être transportée dans le réticulum, où on a la chaine α du CMH classe I.. Ensuite, les
peptides sont transportés dans le réticulum endoplasmique grâce à TAP I et II qui sélectionne les
peptides les plus appropriés. Grâce à d'autres protéines, les peptides sont chargés sur le CMH I.
Quand un peptide adéquate est chargé sur le CMH I, ce dernier devient stable et c'est seulement à ce
moment là qu'il peut être exporté vers le Golgi puis à la surface de la cellule.
Cas 2 : Présentation des complexes CMH I-peptides viraux par les CD non infectées :
présentation croisée
La présentation croisée a été observée par Bevan en 1976 mais ce n'est qu'en 1990 que Rock va
démontrer que les cellules dendritiques ainsi que les macrophages sont capables de «cross-présenter
» des antigènes exogènes particulaires. Ceci est possible sous réserve que ces antigènes soient
5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
1
/
16
100%