Texte de la conférence UTLS du 8 juillet 2002 publié aux

Texte de la conférence UTLS du 8 juillet 2002 publié aux Editions Odile Jacob
« Qu’est-ce que la diversité de la vie ? » ISBN 2-7381-1307-9
1
Texte de la 429e conférence de l'Université de tous les savoirs donnée le 8 juillet 2002
Jean-Claude Weill, « La diversité immunologique »
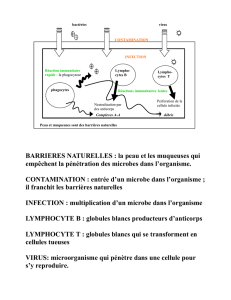
Notre système immunitaire possède plusieurs qualités qui lui confèrent son efficacité.
Tout d’abord, il est spécifique, et peut donc nous protéger contre une infection précise.
Il peut aussi s’améliorer dans le temps, ce qui est une des propriétés de la vaccination :
quand il a rencontré un agent pathogène une première fois, l'organisme sait mieux se
défendre les fois suivantes. De plus, il est doté d’une mémoire : après vaccination, les
lymphocytes qui nous protègent le mieux vont être conservés dans l’organisme pendant
vingt ou trente ans et cela sans que l'on sache encore comment. Enfin, à l’aide d’un
système de filtrage, il distingue le soi et le non soi ce qui évite que le système
immunitaire ne s’attaque à l’organisme et induise des pathologies très graves dites auto-
immunes.
La compréhension des mécanismes de fonctionnement du système immunitaire passe
tout d’abord par l’étude de ses différents acteurs cellulaires et moléculaires, et
notamment les anticorps, les lymphocytes B, et T, les molécules du CMH et les
macrophages.
L’histoire de l’immunologie commence en 430 av. J.-C. Thucydide, qui relate un
épisode de peste à Athènes, écrit avec beaucoup d’intuition : « On se montrait plus
compatissant avec les malades, une fois que l’on avait soi même réussi à surmonter
l’épreuve, car tout en sachant par expérience ce qu’il en était, on se sentait à l’abri du
danger. En effet le mal ne frappait pas deux fois un même homme ou du moins la
rechute n’était pas mortelle. » Il décrit ainsi le principe de la vaccination : une fois que
l’on a été infecté par l’agent pathogène, si l’on n’en meurt pas, on est protégé d’une
nouvelle rencontre avec celui-ci. Il faudra attendre 2 000 ans pour que Edward Jenner,
en 1796, un médecin anglais applique cette leçon de la peste au cas de la variole, dont
les gens meurent à cette époque. Partant de l’observation que les bovins peuvent eux
aussi attraper la variole, il prend un peu de germe de la variole bovine non infectieuse
pour l’homme qu’il inocule à des patients, les protégeant ainsi de la variole humaine.
L’acceptation de cette découverte par les médecins, à travers le monde, prendra encore
50 à 60 ans. Un siècle après, Louis Pasteur montre qu’il n’est pas nécessaire de prendre

Texte de la conférence UTLS du 8 juillet 2002 publié aux Editions Odile Jacob
« Qu’est-ce que la diversité de la vie ? » ISBN 2-7381-1307-9
2
l’agent pathogène d’une autre souche, mais qu’il suffit de chauffer l’agent qui infecte
l’humain, ce qui le rend moins virulent, donc incapable de provoquer la maladie mais
apte à provoquer la vaccination. La question se pose alors, à cette époque, de savoir ce
qui protège les individus contre les maladies : s'agit-il de cellules ou de molécules
contenues dans le sang. Cette controverse oppose Louis Pasteur et Robert Koch.
Emil von Behring montre en 1890 que l’immunité peut être transmise par un sérum du
sang ne contenant pas de cellules. Il appelle les molécules responsables de l’immunité
des anticorps. En 1920, Karl Landsteiner, qui a découvert les groupes sanguins, montre
que l’on peut obtenir des anticorps contre n’importe quelle substance. Le système
immunitaire peut donc réagir contre tout ce qui lui est présenté. Cela pose le problème
de savoir comment fait le système immunitaire pour ne pas reconnaître le soi.
L’ensemble de ces découvertes aboutit à l’oubli total de la théorie cellulaire, et ceci
pendant 50 ans à partir de 1900, sans que soit pour autant résolue la question de savoir
comment sont produits les anticorps. A partir de la deuxième moitié du 20ème siècle, on
redécouvre que le sang contient une multitude de cellules, et l’on s’aperçoit qu’elles
dérivent d’un type de cellules particulières, les cellules souches hématopoïétiques. Ces
dernières donnent naissance à différents types de lignées : la lignée lymphoïde (qui
produira les lymphocytes), la lignée myéloïde (qui produira les lignées phagocytaires,
c’est à dire les macrophages, les monocytes, les granulocytes basophiles, neutrophiles,
et éosinophiles), la lignée erythroide qui produit les globules rouges. Les anticorps sont
produits par des lymphocytes particuliers, de type B. Les lymphocytes de type T
produisent, eux, un autre type de molécules de reconnaissance.
Comme souvent dans les polémiques scientifiques les deux théories contribuent à la
réalité : des cellules et des molécules sont responsables de l’immunité.
Pour bien comprendre le mode d’action des anticorps, il faut raisonner en terme de
reconnaissance. Il faut s’imaginer l’anticorps comme une pince (par exemple anti α) qui
s’adapterait parfaitement à l’objet α, qui le reconnaîtrait : la pince anti α est spécifique
de l’objet α. En revanche, cette pince anti α reconnaîtrait moins bien un objet β. Tout le
système immunitaire va être basé sur ce principe. L’amélioration du système
immunitaire, grâce à la vaccination, provient ainsi de l’amélioration de la
reconnaissance d’une pince anti x spécifique du bacille du tétanos par exemple, ce qui
permettra à cette pince de se débarrasser plus facilement de l’agent pathogène, lors

Texte de la conférence UTLS du 8 juillet 2002 publié aux Editions Odile Jacob
« Qu’est-ce que la diversité de la vie ? » ISBN 2-7381-1307-9
3
d’une nouvelle rencontre. L'amélioration de cette pince va se faire dans les organes
lymphoïdes, rate et ganglions, en une à deux semaines, par hypermutation spécifique
des gènes codant cet anticorps (voir plus bas), et c’est cette cellule lymphoïde fabriquant
cette pince améliorée qui va rester dans l’organisme dix ou vingt ans. Mémoire et
amélioration de la réponse sont donc intimement liées.
Il faut donc un lymphocyte B pour fabriquer un anticorps donné (une pince). Le
lymphocyte B porte à sa surface un anticorps que l’on appelle un récepteur et c’est cet
anticorps qu’il fabrique. Cette cellule x peut ainsi attraper l’élément X. Il en va de
même pour une cellule y avec un élément Y. Le système immunitaire produit ainsi des
millions de cellules qui peuvent reconnaître des millions de corps différents. Ainsi,
chaque fois qu’un virus, une bactérie ou une cellule greffée est introduite dans
l’organisme, il existe un lymphocyte B possédant un récepteur spécifique pour chacun
de ces éléments.
C’est dans la moelle osseuse que sont produites, chaque jour, ces cellules, et aucune des
cellules produites ne va pouvoir s’attaquer à l’organisme, donc porter de récepteur qui
reconnaît le soi. Cela est dû au fait qu’au cours de cette production, dans la moelle
osseuse, une cellule qui reconnaît le soi va être éliminée. C’est ce que l’on appelle la
sélection négative, qui permet au système immunitaire de reconnaître tout l’extérieur
sans attaquer l’intérieur.
Cinq milliards de lymphocytes B sont produits chaque jour dont 95 % vont mourir dans
les 48 heures. Il y en a 400 milliards dans le corps, et nous portons en tout
approximativement 10 millions de spécificités différentes d’anticorps.
La question de la génération de la diversité (Generation Of Diversity) a interpellé les
immunologistes dans les années 70. Il est maintenant connu que le génome ne contient
pas plus de 30 000 gènes. Il est donc exclu que chaque anticorps soit codé par un gène
différent. Linus Pauling a suggéré que le nombre d’anticorps différents soit en réalité
assez restreint, mais que la pince soit assez plastique pour s’adapter à chaque molécule
différente qu’elle rencontre. Cette théorie de l’induction s’est cependant avérée fausse.
La compréhension de ce phénomène de GOD s'effectuera grâce à la biologie
moléculaire.
En 1954, à Cambridge, Jim Watson et Francis Crick font une des plus belles
découvertes du siècle en biologie, et démontrent que le support de l’hérédité est l’ADN,

Texte de la conférence UTLS du 8 juillet 2002 publié aux Editions Odile Jacob
« Qu’est-ce que la diversité de la vie ? » ISBN 2-7381-1307-9
4
une molécule organisée en une double hélice, qu’utilisent toutes les espèces vivantes.
Les longs brins d’ADN sont présents dans chacune de nos cellules, sous la forme repliée
et compactée de nos 23 paires de chromosomes. S’ils étaient débobinés et mis bout à
bout, ils atteindraient une longueur de 1m40 par cellule. Les brins d’ADN sont
composés de la succession de quatre lettres : A, T, G, C que l’on appelle des bases. Le
génome humain en compte deux milliards. L’assemblage linéaire de ces bases n’est pas
neutre : il s’organise en unités de transcription, des gènes, qui ont un début et une fin,
qui codent pour des protéines. Il y a environ 30 000 gènes. Chaque cellule possède le
patrimoine génétique complet mais n’exprime qu’un certain nombre de gènes, qui sont
différents selon que la cellule est une cellule de rétine ou de peau par exemple. Les
autres sont silencieux. Si le gène est exprimé, l’ADN est transcrit en ARN dans le
noyau, puis est traduit, dans le cytoplasme, en une protéine, composée d’acides aminés,
l’anticorps par exemple, le lymphocyte B 1 exprime l’anticorps 1.
Pour expliquer toutes les spécificités d’anticorps existantes, Susumu Tonegawa
démontre qu’il n’existe pas dix millions de gènes, mais que c’est une combinaison qui
permet d’aboutir à ce chiffre. Il propose quatre groupes (V, D, J et C) comportant en
totalité une centaine d’éléments. Chaque lymphocyte, produit dans la moelle osseuse, va
prendre un élément de chaque groupe de manière aléatoire, et ainsi présenter une
combinaison unique (par exemple V69D5J4C2) qui va coder pour un récepteur unique. En
outre, le réarrangement, la recombinaison entre chacun des segments, se fait de manière
imprécise, ce qui aboutit à une diversité supplémentaire. Au moment de l'émigration de
la moelle osseuse, il est vérifié pour chaque cellule que la combinaison n’aboutit pas à
la production d’un récepteur reconnaissant le soi.
Au moment où l’agent pathogène entre dans l’organisme, il rencontre le lymphocyte B
qui a le récepteur spécifique complémentaire de l’antigène à sa surface. Le lymphocyte
B va alors sécréter des milliers d’anticorps, identiques au récepteur présent à sa surface,
qui vont se lier à l’agent pathogène et l’éliminer. La réponse immédiate du système
immunitaire est donc de faire des milliers d’anticorps contre un agent pathogène afin de
se fixer à lui et s’en débarrasser.
Quand une bactérie ou un virus sont présents à l’état complet dans le corps, ce sont les
lymphocytes B qui vont reconnaître cet agent pathogène par l'intermédiaire de leur
anticorps de surface qui va par la suite être sécrété en grande quantité.

Texte de la conférence UTLS du 8 juillet 2002 publié aux Editions Odile Jacob
« Qu’est-ce que la diversité de la vie ? » ISBN 2-7381-1307-9
5
Il existe aussi des infections cellulaires, qui sont très rapides, au cours desquelles un
virus entre dans l’organisme et va immédiatement se loger à l’intérieur d’une cellule, où
il s’intègre dans le génome. Il se sert de la machinerie de la cellule pour subsister :
quand les chromosomes se divisent et se répliquent, le virus, qui y est intégré, se
réplique aussi, transformant ainsi la cellule en usine à virus. Si ces agents n’ont pas été
attaqués lorsqu’ils étaient dans la circulation, le système immunitaire B ne peut plus les
reconnaître maintenant qu’ils sont intracellulaires. C'est notre système immunitaire T
qui va être capable de s’attaquer aux cellules infectées pour les tuer, et ceci en
préservant les cellules saines.
En 1974, Peter Doherty et Rolf Zinkernagel sont à l’origine du concept du soi modifié,
qui introduit deux nouveaux acteurs de la réponse immunitaire : le lymphocyte T et le
CMH (le Complexe Majeur d’Histocompatibilité, HLA chez l’homme pour Human
Leucocyte Antigen), qui représente la carte d’identité biologique d’un individu. Le
complexe HLA est formé de trois gènes, A, B et C, présentant chacun 99 types (on parle
d’haplotypes). Un individu est par exemple A28B96C3. Ces trois protéines, qui
représentent l'équivalent du numéro de sécurité sociale d’un individu, sont présentes à la
surface de toutes les cellules de son organisme. Leur rôle premier est de présenter,
comme dans une vitrine, un échantillon des protéines présentes dans la cellule, sous
forme de fragments peptidiques, que la cellule produit constamment. La plupart du
temps, il s’agit de protéines du soi. Si la cellule est infectée par un virus, elle présente
aussi des morceaux de virus. C’est cela que reconnaît le lymphocyte T : le soi modifié,
le peptide viral présenté dans le contexte du HLA. Le lymphocyte T, qui se différencie
dans le thymus, présente lui aussi une pince à sa surface qui reconnaît le HLA, le
récepteur T, mais ce dernier n’est jamais sécrété. La cellule T scrute constamment le
HLA des cellules qu’elle rencontre. Si elle rencontre une cellule infectée, son récepteur
T reconnaît le soi modifié, et le lymphocyte T la tue ; si la cellule rencontrée est saine, il
y juste reconnaissance du soi et rien ne se passe. Comme pour le lymphocyte B et
l’anticorps présent à sa surface, chaque lymphocyte T porte un récepteur T spécifique à
sa surface, soumis aux mêmes règles quant à la génération de la diversité, des groupes
de plusieurs centaines de gènes se recombinant de manière aléatoire pour le générer.
En revanche, la sélection des cellules T se fait de manière un peu différente. Alors que
la cellule B n’est éliminée que si elle reconnaît, avec une forte affinité, une molécule du
soi pendant le développement, la cellule T passe par une étape de sélection
supplémentaire. En effet, le lymphocyte T doit reconnaître du soi modifié, c’est à dire
 6
6
 7
7
 8
8
1
/
8
100%