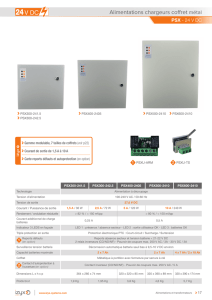
LES ÉQUIPEMENTS

LES ÉQUIPEMENTS
LES BATTERIES
SUPPORT DE COURS
COURS EXP-PR-EQ160
Révision 0.2

Exploration & Production
Équipements
Les batteries
Support de cours : EXP-PR-EQ160-FR
Dernière Révision : 10/07/2007 Page 2 de 186
LES ÉQUIPEMENTS
LES BATTERIES
SOMMAIRE
1. OBJECTIFS .....................................................................................................................8
2. GÉNÉRALITÉS................................................................................................................9
2.1. QU’EST CE QU’UNE BATTERIE ?...........................................................................9
2.1.1. Qu’ont en commun toutes les batteries ? ........................................................10
2.1.2. Qu’est-ce qui différentie les batteries les unes des autres ? ...........................10
2.1.3. Quel est notre but ?.........................................................................................11
2.2. ORIGINE ET HISTORIQUE DES BATTERIES .......................................................12
2.3. CHIMIE D’UNE PILE ÉLECTRIQUE .......................................................................14
2.3.1. Élément de batterie .........................................................................................14
2.3.2. Comment fonctionne un élément de batterie ?................................................15
2.3.3. Processus de décharge...................................................................................18
2.3.4. Recharger ou ne pas recharger.......................................................................18
2.3.5. Choix des produits chimiques actifs ................................................................19
2.4. CONCEPT DE BASE DES BATTERIES.................................................................22
2.4.1. Tension............................................................................................................22
2.4.2. Capacité ..........................................................................................................23
2.4.3. Tension et capacité .........................................................................................23
2.5. ÉLÉMENTS EN SÉRIE ET EN PARALLÈLE ..........................................................24
2.5.1. Éléments reliés en série ..................................................................................24
2.5.2. Éléments reliés en parallèle ............................................................................25
2.6. RÉSISTANCE INTERNE D’UNE BATTERIE ..........................................................28
2.7. ÉLECTROLYTE ......................................................................................................30
2.7.1. Les deux électrolytes de la pile Daniell............................................................30
2.7.2. Densité de l’électrolyte liquide (élément liquide)..............................................32
2.7.3. Recommandations pour la manipulation de l’électrolyte..................................33
2.8. TERMINOLOGIE DES BATTERIES........................................................................34
2.9. DENSITÉ D’ÉNERGIE ............................................................................................36
2.10. EXERCICES .........................................................................................................37
3. CONSTRUCTION ET TECHNOLOGIE DES BATTERIES ............................................40
3.1. COMPOSANTS.......................................................................................................40
3.1.1. Boîtier..............................................................................................................40
3.1.2. Électrodes .......................................................................................................40
3.1.3. Séparateur.......................................................................................................40
3.1.4. Bornes.............................................................................................................41
3.1.5. Électrolyte........................................................................................................41
3.2. CONSTRUCTION INTERNE...................................................................................42
3.2.1. Électrodes (Compromis puissance/énergie)....................................................42
3.2.2. Électrodes de type aggloméré.........................................................................43
3.2.3. Électrodes à plaques planes ...........................................................................44
3.2.4. Électrodes spiralées (construction enroulée)...................................................45
3.2.5. Piles bouton ou pile ‘pièce’..............................................................................46

Exploration & Production
Équipements
Les batteries
Support de cours : EXP-PR-EQ160-FR
Dernière Révision : 10/07/2007 Page 3 de 186
3.2.6. Éléments à électrode multiple .........................................................................46
3.2.6.1. Configuration monopolaire .........................................................................46
3.2.6.2. Configuration bipolaire ...............................................................................46
3.3. INTERCONNECTIONS D’ÉLECTRODES ..............................................................48
3.4. BATTERIES ÉTANCHES ET À RECOMBINAISON................................................48
3.4.1. Électrolyte des batteries étanches...................................................................48
3.4.2. Soupapes de sécurité pour batteries étanches ...............................................49
3.5. BOITIER DE BATTERIE .........................................................................................50
3.5.1. Batteries cylindriques ......................................................................................50
3.5.2. Pile/batteries multi-éléments ...........................................................................51
3.5.3. Taille des piles/batteries courantes (à la maison)............................................51
3.5.4. Piles bouton et piles pièces.............................................................................52
3.5.5. Piles de type sachet ........................................................................................52
3.5.6. Batteries prismatiques.....................................................................................54
3.5.7. Batteries en couche mince ..............................................................................55
3.5.8. Batteries grande puissance.............................................................................56
3.5.9. Batteries de puissance ....................................................................................57
4. LES DIFFÉRENTS TYPES DE BATTERIES .................................................................59
4.1. NOMENCLATURE ..................................................................................................59
4.1.1. Identification des batteries...............................................................................59
4.1.2. Exemples.........................................................................................................60
4.1.2.1. Piles courantes (élément primaire).............................................................60
4.1.2.2. Batteries cylindriques de faible puissance .................................................61
4.1.2.3. Batteries/piles prismatiques .......................................................................62
4.2. ELEMENTS PRIMAIRES ........................................................................................64
4.2.1. Piles Leclanché (carbone-zinc) .......................................................................65
4.2.1.1. Caractéristiques .........................................................................................65
4.2.1.2. Avantages ..................................................................................................65
4.2.1.3. Inconvénients.............................................................................................66
4.2.1.4. Applications................................................................................................66
4.2.1.5. Prix.............................................................................................................66
4.2.2. Piles alcalines..................................................................................................67
4.2.2.1. Caractéristiques .........................................................................................67
4.2.2.2. Avantages ..................................................................................................68
4.2.2.3. Inconvénients.............................................................................................68
4.2.2.4. Applications................................................................................................68
4.2.2.5. Prix.............................................................................................................69
4.2.3. Piles à l’oxyde d’argent....................................................................................69
4.2.3.1. Caractéristiques .........................................................................................69
4.2.3.2. Avantages ..................................................................................................69
4.2.3.3. Inconvénients.............................................................................................69
4.2.3.4. Applications................................................................................................70
4.2.3.5. Prix.............................................................................................................70
4.2.4. Piles zinc air ....................................................................................................70
4.2.4.1. Caractéristiques .........................................................................................70
4.2.4.2. Avantages ..................................................................................................71
4.2.4.3. Inconvénients.............................................................................................71
4.2.4.4. Applications................................................................................................72

Exploration & Production
Équipements
Les batteries
Support de cours : EXP-PR-EQ160-FR
Dernière Révision : 10/07/2007 Page 4 de 186
4.2.4.5. Prix.............................................................................................................72
4.2.5. Piles au lithium ................................................................................................73
4.2.5.1. Caractéristiques .........................................................................................73
4.2.5.2. Avantages ..................................................................................................73
4.2.5.3. Inconvénients.............................................................................................74
4.2.5.4. Applications................................................................................................74
4.2.5.5. Prix.............................................................................................................75
4.2.6. Piles amorçables .............................................................................................75
4.2.6.1. Caractéristiques .........................................................................................75
4.2.6.2. Avantages ..................................................................................................76
4.2.6.3. Inconvénients.............................................................................................76
4.2.6.4. Applications................................................................................................76
4.2.6.5. Prix.............................................................................................................76
4.2.7. Piles thermiques..............................................................................................77
4.2.7.1. Caractéristiques .........................................................................................77
4.2.7.2. Avantages ..................................................................................................77
4.2.7.3. Inconvénients.............................................................................................78
4.2.7.4. Applications................................................................................................78
4.2.7.5. Prix.............................................................................................................78
4.3. BATTERIES ............................................................................................................79
4.3.1. Plomb acide.....................................................................................................80
4.3.1.1. Caractéristiques .........................................................................................80
4.3.1.2. Avantages ..................................................................................................81
4.3.1.3. Inconvénients.............................................................................................82
4.3.1.4. Charge .......................................................................................................83
4.3.1.5. Applications................................................................................................83
4.3.1.6. Prix.............................................................................................................84
4.3.1.7. Gamme de batteries plomb acide ..............................................................84
4.3.2. Fer nickel.........................................................................................................87
4.3.2.1. Caractéristiques .........................................................................................87
4.3.2.2. Avantages ..................................................................................................87
4.3.2.3. Inconvénients.............................................................................................87
4.3.2.4. Applications................................................................................................88
4.3.3. Nickel Cadmium ..............................................................................................89
4.3.3.1. Caractéristiques des piles sèches..............................................................89
4.3.3.2. Caractéristiques des batteries industrielles................................................89
4.3.3.3. Avantages ..................................................................................................92
4.3.3.4. Inconvénients.............................................................................................92
4.3.3.5. Charge .......................................................................................................93
4.3.3.6. Applications................................................................................................93
4.3.3.7. Prix.............................................................................................................94
4.3.4. Nickel métal hydrure........................................................................................94
4.3.4.1. Caractéristiques .........................................................................................94
4.3.4.2. Avantages ..................................................................................................95
4.3.4.3. Inconvénients.............................................................................................96
4.3.4.4. Charge .......................................................................................................96
4.3.4.5. Applications................................................................................................97
4.3.4.6. Prix.............................................................................................................97

Exploration & Production
Équipements
Les batteries
Support de cours : EXP-PR-EQ160-FR
Dernière Révision : 10/07/2007 Page 5 de 186
4.3.5. Nickel Zinc.......................................................................................................97
4.3.5.1. Caractéristiques .........................................................................................97
4.3.5.2. Avantages ..................................................................................................97
4.3.5.3. Inconvénients.............................................................................................98
4.3.5.4. Applications................................................................................................98
4.3.5.5. Prix.............................................................................................................98
4.3.6. Accumulateurs lithium .....................................................................................98
4.3.6.1. Caractéristiques .........................................................................................98
4.3.6.2. Avantages ..................................................................................................99
4.3.6.3. Inconvénients...........................................................................................100
4.3.6.4. Charge .....................................................................................................101
4.3.6.5. Applications..............................................................................................102
4.3.6.6. Prix...........................................................................................................102
4.3.6.7. Autres variétés de batteries rechargeables au lithium..............................102
4.3.7. Sodium soufre ...............................................................................................106
4.3.8. Batteries à circulation (Redox) ......................................................................107
4.3.8.1. Caractéristiques .......................................................................................107
4.3.8.2. Avantages ................................................................................................107
4.3.8.3. Inconvénients...........................................................................................107
4.3.8.4. Applications..............................................................................................107
4.3.8.5. Prix...........................................................................................................108
4.3.9. Batteries Zebra..............................................................................................108
4.3.9.1. Caractéristiques .......................................................................................108
4.3.9.2. Avantages ................................................................................................108
4.3.9.3. Inconvénients...........................................................................................108
4.3.9.4. Applications..............................................................................................109
4.3.9.5. Prix...........................................................................................................109
4.3.10. Autres piles galvaniques..............................................................................109
4.3.10.1. Batteries à électrolyte solide ..................................................................109
4.3.10.2. Nanotechnologies ..................................................................................109
4.3.10.3. Batteries au mercure..............................................................................110
4.3.10.4. Batteries nickel hydrogène (Ni-H2) ........................................................110
4.3.10.5. Batteries métal air ..................................................................................110
4.3.10.6. Batteries rechargeables aluminium-air...................................................110
4.4. BATTERIES PEU COURANTES...........................................................................111
4.4.1. Batterie à l’urine ............................................................................................111
4.4.2. Batteries Ampoule .........................................................................................111
4.4.3. Batterie « maison » .......................................................................................111
4.5. TABLEAU RÉCAPITULATIF – ACCUMULATEURS.............................................113
5. CHARGE DES BATTERIES (CHARGEUR DE BATTERIE) ........................................115
5.1. COMMENT CHARGER ACCUMULATEURS OU BATTERIES ............................115
5.1.1. Charge des batteries plomb acide.................................................................116
5.1.1.1. Charge des batteries au plomb en 2 étapes.............................................117
5.1.1.2. Charge des batteries au plomb en 3 étapes.............................................118
5.1.2. Charge des batteries nickel-cadmium ...........................................................119
5.1.2.1. Charge normale .......................................................................................119
5.1.2.2. Charge accélérée.....................................................................................120
5.1.2.3. Charge rapide ..........................................................................................120
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
 165
165
 166
166
 167
167
 168
168
 169
169
 170
170
 171
171
 172
172
 173
173
 174
174
 175
175
 176
176
 177
177
 178
178
 179
179
 180
180
 181
181
 182
182
 183
183
 184
184
 185
185
 186
186
1
/
186
100%