Travaux pratiques

T
Tr
ra
av
va
au
ux
x
p
pr
ra
at
ti
iq
qu
ue
es
s
LP214
2009-2010

1
RÈGLEMENT
LES TRAVAUX PRATIQUES SONT OBLIGATOIRES :
La présence à toutes les séances de Travaux Pratiques est OBLIGATOIRE.
Absences justifiées :
Une absence est justifiée par une feuille d’arrêt maladie. Les simples certificats médicaux ne
sont pas acceptés. Seuls seront acceptés les feuilles d’arrêt maladie remises au secrétariat dans
un délai de six jours après le retour de l’étudiant.
Notez bien que :
- les réveils qui ne sonnent pas
- les trains qui arrivent en retard
ne constituent pas un motif d’absence. Il faut aller à la séance prévue, même en retard. De
plus : il n’y aura aucun rattrapage pour les étudiants ayant manqué une séance pour s’être
trompés dans le calendrier
.

2
T
TP
P1
1
D
DI
IF
FF
FU
US
SI
IO
ON
N
A
A
T
TR
RA
AV
VE
ER
RS
S
U
UN
NE
E
M
ME
EM
MB
BR
RA
AN
NE
E

3
D
DI
IF
FF
FU
US
SI
IO
ON
N
A
A
T
TR
RA
AV
VA
AE
ER
RS
S
U
UN
NE
E
M
ME
EM
MB
BR
RA
AN
NE
E
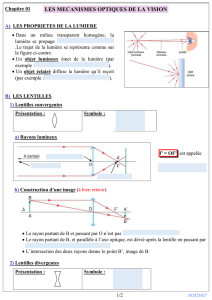
But de la manipulation
Mesurer la perméabilité d’une membrane de cellulose en suivant l’évolution de la
concentration d’une solution de permanganate de potassium qui se répartit dans deux
compartiments séparés par la membrane. La diffusion d’une substance non chargée est régie
par la loi de Fick.
I. Principe
Un boudin de cellulose est fixé à une extrémité à un anneau et est obturé à l’autre extrémité
par une pince (figure 1). On remplit le boudin d’un volume V1 d’une solution de permanganate
de potassium. On suit alors l’évolution en fonction du temps de la concentration de
permanganate de potassium dans le compartiment V1. A l’aide de la courbe obtenue, on
calcule la perméabilité de la membrane soit à partir du flux initial en utilisant directement la
loi de Fick, soit en utilisant l’équation intégrée donnant l’évolution de la concentration en
fonction du temps (voir TD 5). La concentration est mesurée par absorption de la lumière à
l'aide d'un spectrophotomètre : plus la concentration est grande, plus l'absorption est grande
(voir plus loin).
II. Réalisation pratique
A. Montage expérimental
On dispose d’un boudin de 10 cm de long. Enfiler une extrémité du boudin dans l’entonnoir
en plastique et le fixer sur l’anneau avec un élastique ; l’autre extrémité sera obturée par une
pince. Fixer l’anneau sur un support. Le boudin doit faire environ 7 cm de long. On remplit le
boudin jusqu’au niveau de l’anneau d’un volume V1 mesuré à l’aide d’une éprouvette graduée,
d’une solution de permanganate de potassium de concentration 0,5g/l (solution mère). On
plonge le boudin dans un grand bêcher de 750 ml que l’on remplit de telle sorte que le niveau
d’eau soit le même à l’intérieur et à l’extérieur du boudin. Noter le volume précis V2 d'eau
distillée versée dans le grand bêcher. Brancher immédiatement le bulleur, permettant
d’homogénéiser l’intérieur du boudin et noter le temps t = 0.

4
B. Manipulation
Pour effectuer les prélèvements, retirer le bulleur, prélever à la seringue puis remettre le
bulleur en place. A des temps conformes au tableau suivant, prélever à l’aide d’une seringue
de 1ml, 0,3ml de V1 et placer chaque prélèvement dans une cuve à spectrophotométrie.
Rajouter précisément à l’aide d’une seringue de 2ml, 1,5ml d’eau distillée dans chaque cuve.
Le facteur de dilution correspondant à cette opération est donc : (1,5+0,3) / 0,3= 6.
Dates des différents prélèvements à faire :
- Compartiment 1 (boudin)
t (mn) :0 (solution mère), 8, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60
- Compartiment 2 (bêcher)
t (mn), 40,50,60
Faire un tableau (1) avec à chacune de ces dates la densité optique D de chaque échantillon
(voir méthode ci-dessous).
C. Mesure des concentrations : réalisation d’une courbe d’étalonnage
Définitions :
Une intensité lumineuse I0 arrive sur un milieu absorbant. Une partie est absorbée et en sortie
l'intensité vaut I < I0. On défini la transmission t et la densité optique D par :
La loi de Beer-Lambert indique que D est proportionnelle à la concentration C :
À partir de la solution A (0,5g/l), préparer les solutions suivantes dans les cuves à
spectrophotométrie (ED signifie eau distillée) :
Réglage du spectrophotomètre :
Régler la longueur d’onde à 586 nm.
Sur une cuve contenant de l’eau distillée régler le facteur de transmission à 100% : D =0.
Agiter les 4 solutions et mesurer leur densité optique.
Remplir le tableau 2 et tracer la courbe d’étalonnage C = f(D).
D. Résultats
1. À l’aide de la courbe d’étalonnage, reporter dans le tableau 1 les valeurs exactes des
concentrations C1 et C2 en ayant tenu compte du facteur de dilution.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
1
/
30
100%