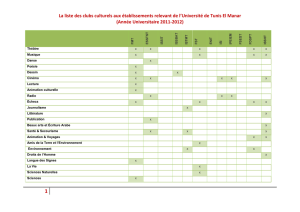
A la suite de l*étude des francolites naturels, une série de

Etude thermochimique et cinétique de l’attaque phosphorique de
fluorapatites variablement carbonatées de type "B" à différentes
températures
Houda ZENDAH BEN SALEM , Ismail KHATTECH et Mohamed JEMAL
Université de Tunis El Manar, Faculté des Sciences de Tunis, Laboratoire de Thermodynamique Appliquée
(LR01SE10), Tunis El Manar 2092, Tunis, Tunisie
Les engrais phosphatés sont obtenus par attaque sulfurique et/ou phosphorique des
phosphates naturels. Pour appréhender le comportement de ces matériaux lors de l’attaque par
l’acide phosphorique, une étude microcalorimétrique de cette réaction a été réalisée à
différentes températures, sur une série de fluorapatites synthétiques variablement carbonatées
de type B (B-CO3-Faps). Les expériences ont été effectuées dans un microcalorimètre Calvet
du type C-80 de SETARAM. L’intervalle de température exploré est compris entre 25 et
55°C, la réaction d’attaque a été réalisée avec une solution d’acide phosphorique à 19 % en
masse de P2O5.
L’étude thermochimique et cinétique de la dissolution des B-CO3-Faps synthétiques, a
été effectuée sur les thermogrammes bruts et déconvolués. L’enthalpie molaire de cette
réaction, déterminée par intégration du signal brut, augmente avec la température de -200 à
-140 kJ mol-1. Pour l’étude cinétique réalisée sur les thermogrammes déconvolués en
appliquant le modèle d’Avrami a permis de montrer que la dissolution de ces phosphates se
produit en une seule étape ; le schéma réactionnel suivant a été proposé :
Ca (10 – x + u) (PO4)(6 – x)(CO3)x F(2 – x + 2 u)](sd) + (14 – x + 2 u) [H3PO4](aq)
(10–x+u)[Ca2+](aq) +(2–x+2u)[F-](aq) +x[H2O,CO2](aq) +(18 –x)[H2PO4-](aq)+(2-+2u)[H3PO4](aq)
avec 0 ≤ x ≤ 2 et u ≤ x/2
Ainsi, il a été possible de déterminer le flux thermique selon l’expression suivante :
nn
rapp qQHVk
dt
dq )-()( -1
avec "ΔrH" l’enthalpie molaire de la réaction de dissolution, "V" le volume du milieu
réactionnel, "q" quantités de chaleur dégagée à l’instant t et "Q" quantités de chaleur dégagée
au terme de la réaction.
L’itération de cette équation conduit à des courbes expérimentales et théoriques qui
coïncident pour un ordre partiel par rapport à l’apatite égale à deux et une constante apparente
de vitesse croissante avec la température. Par ailleurs, l’augmentation de la quantité de
carbonate apatitique génère une diminution de l'énergie d'activation de 16 à 8 kJ mol-1
indiquant que la réaction de dissolution est commandée par un phénomène diffusionnel.
1
/
1
100%