Techniques d`ionisation et analyseurs

1
CHM 2971 H06
• Quelle serait la masse approx. en se basant sur le rapport isotopique?
• La masse indiquée est-elle nominale, moyenne ou exacte?
• Si la form. emp. est C64H103N23O30, combien d’atome 12C contient
l’ion a 1674.72?
Substance P(âques)
Séquence:
THREE EASTER EGGS
1673.72
1670 1672 1674 16801676 1678
1674.72
• Quelle est la resolution si la largeur de a 50% est de 0.17 m/z?
Questions – Mesure de masse
0.17 m/z
Règle de l’azote: Masse moléculaire paire pour un # pair d’atome d’azote

2
CHM 2971 H06
Technique
d’ionisation Principe Analytes Limite de
detection Commentaires
Impact electronique
(EI) Impact d’électron
de 70eV avec
molécules
neutres gazeuse
Molecules volatiles <
1000 Da et
thermiquement
stables
Bas pg Gain significatif
d’energie interne
(> 10eV) i.e. ion
fragments
Ionisation chimique
(CI) Addition (+) ou
abstraction (-)
electrophile avec
gas ionisant
Molecules volatiles <
1000 Da, depend de
l’affinite protonique
(PA)
~10-50 pg Gas ionisants (CH4,
AP:552 kJ/mol) NH3,
AP: 854 kJ/mol) – Eint.
Ionisation/
désorption par
champ élect. (FI/FD)
Cationisation
(+H, Na) avec sel Polymères jusqu’a
3.5 kDa ~50-100 pg Champ de 2V/Ǻ,
analyte depose sur
emetteur de graphite
Bomb. d’atomes
rapides (FAB) ou
d’ions rapides
(LSIMS)
Echange de
proton (ou adduit
d’alkalin) avec
matrice
Biopolymeres
jusque’a 20 kDa ~ng (pmols) FAB: Xe: ~8 keV,
LSIMS: Cs+: ~30 keV,
Matrice: glycérol,
thioglycérol, DTT/ET
Nébulisation
électrostatique (ESI) Nebulisation
d’especes ionique
en solution sous
un champ elect.
Biopolymeres
jusque’a 1MDa ~1 fmole Peu de fragmentation.
Ions multiplement
chargés
Désorption laser
avec matrice
(MALDI)
Desorption/ionisa
tion avec matrice
absorbant UV
Biopolymeres
jusque’a 300kDa ~1 fmole Peu de fragmentation,
ions simplement
chargés
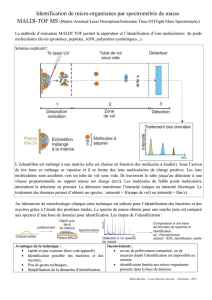
Spectrométrie de masse

3
CHM 2971 H06
Spectrométrie de masse
Techniques d’ionisation - Désorption laser avec matrice
Impulsion laser de 4 ns (λ337 nm , N2, 106-107W/cm-2)
±30 kV
To MS
Échantillon + matrice m/z 15000
10000
[M+H]+
Caractéristiques:
Analytes: Biomolecules jusqu’à - 500 kDa
Sensibilité: 1-10 pg (-1-10 fmoles)
Précision: Avec TOF ±0.02% (ext.), ±0.005% (int.)
Résolution: Avec TOF 15,000 (<10kDa), <1000 @ >20 kDa
Purete de l’ech.: Moindre susceptibilité à la présence de sels (mM)
Matrice: Absorbe en UV, dépend de l’analyte, peut causer un
bruit de fond < 800 Da
Zone d’irradiation
de 0.05-0.2 mm

4
CHM 2971 H06
Impulsion laser de 4 ns
106W/cm2(λ337 nm , N2)
Echantillon + matrice (1:5000)
Co-crystallisation
International Journal of Mass Spectrometry 200 (2000) 71–77
Mass Spectrometry Reviews, 17 (1998), 337–366
Spectrométrie de masse
Techniques d’ionisation - Désorption laser avec matrice

5
CHM 2971 H06
UV/visible regions λ
Excimer gaz rares: ArF 193 nm
KrF 248 nm
XeCl 307 nm
XeF 351 nm
Azote 337 nm
Infrarouge
Er:YAG fondamentale 2.94 µm
CO29.6 nm, 10.6 µm
Plus communs
Laser Science Inc. VSL-337ND nitrogen laser. Specifications : 250µJ/impulsion, 3 ns
temps d’impulsion. Duree de vie ~ 2-4 ans.
Spectrométrie de masse
Techniques d’ionisation - Désorption laser avec matrice
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
1
/
61
100%