La lumière des étoiles Thème: Univers Sous

La lumière des étoiles
Thème: Univers
Sous-thème: Les étoiles
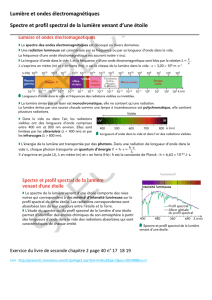
I – Spectre d'émission des corps chauffés
1°) Expérience
On réalise le spectre de la lumière émise par une lampe à
incandescence (p. 256).
On observe sur l'écran le spectre d'émission de la lampe (p. 256).
Lorsque la température du filament de la lampe augmente, le
spectre s'enrichit de couleurs vers le violet.
2°) Conclusion
Les corps chauds émettent de la lumière dont le spectre est
continu. Lorsque la température du corps augmente, le spectre
s'enrichit vers le violet.
Le profil en intensité du spectre d'un corps chaud permet de
mesurer sa température.
Animation :
http://www.ostralo.net/3_animations/swf/spectres_temperature.swf
La longueur d'onde notée λ (lambda) caractérise une radiation
lumineuse (une couleur) du spectre visible par l'oeil.
lampe
fente réseau écran

Le spectre visible s'étend de 400 nm (violet) à 800 nm (rouge)
3°) Application à la mesure de la température des étoiles
Les spectres stellaires, réalisés par des spectrographes installés
sur des télescopes, permettent de mesurer la température de
surface des étoiles.
Les étoiles présentent des couleurs allant du rouge pour les plus
« froides » au blanc bleuté pour les plus « chaudes ».
Etoile Bételgeuse Soleil Sirius Rigel
couleur rouge-
orangée
jaune blanche Blanc-bleu
Température
de surface
(°C) 3000 5800 1100 20000
II – Spectres d'émission des éléments chimiques
1°) Expérience
On réalise le spectre de lampes à vapeur de sodium, de mercure
(p. 258 et 261) et des tubes d'éclairages de la salle.
On observe au spectroscope une raie jaune brillante dans le
spectre du sodium et quelques raies colorées dans le spectre du
mercure et celui des tubes d'éclairage.
2°) Conclusion
Dans certaines conditions, les éléments chimiques émettent de la
lumière dont le spectre est discontinu. Ce spectre contient des raies
caractéristiques de l'élément chimique émetteur.
Animation :
http://www.ostralo.net/3_animations/swf/spectres_soleil.swf
III – Spectre d'absorption
1°) Expérience
On reprend l'expérience du §I en plaçant un récipient transparent
contenant des solutions colorées après la fente (sulfate de cuivre

bleu, permanganate de potassium rose, diiode jaune).
On observe que des bandes de couleurs sont absentes du spectre
sur l'écran. Les espèces chimiques colorées en solution ont
absorbé ces bandes. Le spectre observé est un spectre
d'absorption.
On saupoudre du chlorure de sodium dans la flamme d'un bec de
gaz: on observe qu'il manque dans le spectre de la flamme la raie
jaune observée précédemment .
Les ions sodium chauffés ont absorbé la raie jaune du spectre de la
lumière blanche (doc. 11 et 12 p. 259).
Animation :
http://www.ostralo.net/3_animations/swf/spectres_abs_em.swf
2°) Conclusion
Des espèces chimiques colorées présentes en solution absorbent
certaines bandes dans le spectre de la lumière blanche qui les
traverse.
Des gaz sous faible pression absorbent des raies dans le spectre
de la lumière blanche qui les traverse.
Les bandes et raies d'absorption sont caractéristiques des éléments
chimiques qui les produisent.
Une espèce chimique ne peut absorber que les radiations qu'elle
peut émettre.
IV – Application: analyse spectroscopique
L'étude du spectre de la lumière émise par un objet chauffé permet
d'en déduire sa composition chimique.
Spectre du Soleil: détermination de la composition chimique de
l'atmosphère solaire.
Idem pour les spectres stellaires.
Animation :
http://physicus.free.fr/seconde/seconde_univers_chap05.php
Résumé:
Spectres d'émission:
Spectre continu produit par lampe à incandescence, corps chauffés.
Spectre de raies produit par éléments chimiques à l'état gazeux
chauffés.

Spectres d'absorption:
Spectre avec raies d'absorption (ex :spectres d'étoiles).
Spectres avec bandes d'absorption produit par la lumière blanche
qui a traversé une substance colorée.
1
/
4
100%