BIOMED2 CPaquet nov2010 - Association des Cytologistes du

1
Détection de la clonalité des lymphocytes
par la technique de PCR (BIOMED-
2)
et son utilité
dans le diagnostic
des tumeurs hématopoiétiques
Claudie Paquet Ph.D
.
Biologiste molé
culaire
Service de pathologie
CHA - Hôpital Saint-Sacrement, Québec
Journée scientifique de l’ACQ
Drummondville
11 novembre 2010
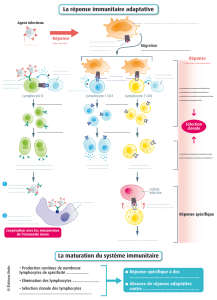
→Clonalité des lymphocytes
-lymphocyte B, lymphocyte T
-principe de clonalité
-leucémies, lymphomes
→PCR BIOMED-2
→Détection de la clonalité par PCR au laboratoire
d’oncopathologie moléculaire de HSS
-types de spécimens
-cheminement d’un spécimen
→Interprétation des résultats
-algorithme de détection de BIOMED-2
-importance de la taille des produits de PCR
-cas difficiles
PLAN
CLONALITÉ DES LYMPHOCYTES
Hématopoièse: processus de production des cellules sanguines •
Lymphocyte B (cellule B)
– production d’immunoglobulines (anticorps)
-reconnaissent des antigènes extracellulaires (ex: pathogène, toxine)
-présentation de l’antigène au lymphocyte B (ex: par un macrophage)
-différenciation du lymphocyte B en plasmocyte, fabrication et sécrétion d’anticorps qui
se fixent à l’antigène activateur et destruction de l’antigène
-lymphocyte B fabrique un seul type d’anticorps et réagit contre un antigène précis
CLONALITÉ DES LYMPHOCYTES
IMMUNOSPÉCIFICITÉ

2
•
Lymphocyte T (cellule T)
-reconnaissent des antigènes produits à l’intérieur des cellules (ex: pathogène
(bactérie, virus) qui infecte une cellule).
-antigène doit être présenté au lymphocyte T
-les molécules du CMH – complexe majeur d’histocompatibilité – glycoprotéines qui
transportent des fragments du pathogène à la surface de la cellule infectée et
présentent le pathogène au lymphocyte T.
-le lymphocyte T activé:
●production de cytokine (CD4+ T-cell)
●induit la prolifération des lymphocytes B
●élimine directement la cellule infectée
(CD8+ cytotoxic T-cell)
-récepteur des cellules T
(TCR - T cell receptor)
-récepteur membranaire à la surface du lymphocyte T
qui reconnait les peptides antigéniques qui lui sont
présentés par le CMH.
-chaque lymphocyte T possède un TCR unique
spécifique pour un peptide antigénique
CLONALITÉ DES LYMPHOCYTES
IMMUNOSPÉCIFICITÉ
CLONALITÉ DES LYMPHOCYTES
Tumeurs hématopoiétiques
•
Leucémie:
cancer du sang et de la moelle osseuse
Prolifération anormale et excessive des globules
blancs qui finissent par envahir complètement la
moelle osseuse et le sang.
-Globules blancs cancéreux retrouvés de façon anormale
dans la circulation sanguine.
-Moelle osseuse: origine du globule blanc cancéreux
(neutrophile, monocyte, lymphocyte B ou T)
•
Lymphome:
cancer des ganglions lymphatiques. Globules blancs cancéreux
prolifèrent dans les ganglions. Expansion des ganglions lymphatiques. Masse
palpable.
-Ganglions lymphatiques atteints peuvent aussi envahir d’autres organes et
apparaître de façon anormale à certain endroits du corps
-Système lymphatique: origine du globule blanc cancéreux (lymphocyte B ou T)
-Lymphome Hodgkiniens: maladie de Hodgkin ou lymphome de Hodgkin est un type de
lymphome caractérisé par la présence de grosses cellules atypiques
(cellules de Reed-Sternberg)
-Lymphome non-Hodgkiniens: autres lymphomes, différents degrés de malignité
(lymphomes
folliculaires, les lymphomes MALT, lymphomes à cellules du manteau, lymphomes diffus à grandes cellules, ...)
CLONALITÉ DES LYMPHOCYTES
•Clonalité: groupe de cellules génétiquement identiques à une cellule
« ancestrale » unique.
Théorie de la clonalité: une cellule unique est à l’origine d'une lésion néoplasique
-La cellule tumorale initiale = clone principal se divise (croissance) et génère une population
clonale (identique) de cellules tumorales →cancer
-Une tumeur maligne est souvent monoclonale ou clonale
-Lésion non cancéreuse (réactionnelle) est plutôt polyclonale (non-clonale)
-Analyse de la clonalité: outil de diagnostic pour les lymphoproliférations malignes
Clonalité ≠malignité
-Population clonale de lymphocytes observées dans certains processus réactionnels
Tumeurs hématopoiétiques (leucémie ou lymphome)
-origine d’un seul lymphocyte (B ou T) cancéreux
-présence d’une population clonale de lymphocytes
-présente une combinaison spécifique et unique
des gènes des Ig ou des gènes du TCR
CLONALITÉ DES LYMPHOCYTES
Lymphome B = population clonale de lymphocytes B qui auront tous le même
réarrangement dans leurs gènes codant pour les Ig
Lymphome T = population clonale de lymphocytes T qui auront tous le même
réarrangement dans leurs gènes codant pour les TCR

3
Lymphocyte B : spécificité de l’immunoglobuline produite
CLONALITÉ DES LYMPHOCYTES
Immunoglobuline - Ig (anticorps)
-2 chaînes lourdes identiques (IGH)
-2 chaînes légères identiques
soit kappa (IGK) ou lambda (IGL)
lymphocyte B: IgH κ
κκ
κ
+
+ +
+
ou IgH λ
λλ
λ
+
++
+
Lymphocyte T : spécificité du TCR exprimé
TCR
-Récepteur hétérodimère: α β
α β α β
α β ou γ δ
γ δγ δ
γ δ
-lymphocyte T: αβ
αβαβ
αβ
+
+ +
+
γ δ
γ δγ δ
γ δ
−
−−
−
ou αβ
αβαβ
αβ
−
−−
−
γ δ
γ δγ δ
γ δ
+
++
+
⇒réarrangements particuliers dans les gènes des Ig et des TCR
Pendant la différenciation des lymphocytes B et T:
-Réarrangements dans les gènes qui codent pour les Ig et TCR
régions variable (V), diversity (D) et joining (J) = recombinaison VDJ
CLONALITÉ DES LYMPHOCYTES
1- Combinaison au
hasard d’un segment
V, un segment D et un
segment J = segment
fonctionnel VDJ
2- Délétion et insertion
au hasard de
nucléotides aux
jonctions V-D et D-J
3- mRNA →Ig
→Diversité énorme
des Ig et TCR =
éliminer une vaste
gamme d'antigènes
Lymphocyte B
Réarrangement des gènes des Ig
-pendant la diffé
renciation
-indépendant de la stimulation Ag
1) réarrangement chaîne lourde
DH-JH (incomplet)
2) réarrangement chaîne lourde
VH-DH-JH (complet)
3) réarrangement chaîne légère kappa
VK-JK
4) réarrangement chaîne légère lambda
VL-JL
5) gène fonctionnel V-D-J
⇒mRNA ⇒Ig
Exclusion allélique: expression λou κ
CLONALITÉ DES LYMPHOCYTES CLONALITÉ DES LYMPHOCYTES
Lymphocyte T
Réarrangement des gènes TCR
-pendant la différenciation
1) réarrangement chaîne delta
V-D-J
2) réarrangement chaîne gamma
V-J
3) réarrangement chaîne bêta
V-D-J
4) réarrangement chaîne alpha
V-J
5) gène fonctionnel V-D-J
⇒mRNA ⇒TCR

4
CLONALITÉ DES LYMPHOCYTES
-Majorité des patients avec suspicion d’un désordre lymphoprolifératif:
-histologie, immunohistochimie, cytométrie de flux →DIAGNOSTIC
-Dans 5-15% des cas, le diagnostic est plus difficile
-évaluation de la clonalité des lymphocytes par PCR
→outil de DIAGNOSTIC
CLONALITÉ DES LYMPHOCYTES
→Clonalité des lymphocytes
-lymphocyte B, lymphocyte T
-principe de clonalité
-leucémies, lymphomes
→PCR BIOMED-2
→Détection de la clonalité par PCR au laboratoire
d’oncopathologie moléculaire de HSS
-types de spécimens
-cheminement d’un spécimen
→Interprétation des résultats
-algorithme de détection de BIOMED-2
-importance de la taille des produits de PCR
-cas difficiles
PLAN
-Grande diversité des lymphocytes exploitée dans l’évaluation de la clonalité
des lymphocytes par PCR
Gène IGH, réarrangement VH-JH
Diversité de la
région D
-Amorçes V et J
-Amplification du réarrangement V-D-J (PCR)
-Migration des produits de PCR sur gel
-Visualisation de la taille (paire de bases) des produits de PCR
-Si population hétérogène de lymphocytes B (tous différents, polyclonale) = produits
de PCR de différentes tailles
-Si population clonale d’un lymphocyte B (identiques; lymphome?) = abondance d’un
seul produit de PCR d’une taille spécifique
Juxtaposition au
hasard des
segments V-D-J
PCR - résumé
PCR BIOMED-2

5
PCR BIOMED-2
BIOMED-2
-Consortium européen (BMH4-CT98-3936)
-But: introduire une méthode de détection de la clonalité par PCR fiable et reproductible
-Standardiser les réactifs et les protocoles
-Intégration possible dans une routine de laboratoire de diagnostic clinique
-1998 à 2002
J.J.M. van Dongen, M.D., Ph.D. Department of Immunology,
University Medical Center, Rotterdam, The Netherlands
1-développer et standardiser les protocoles de PCR et les amorçes
-développer des lignes directrices pour l’interprétation des résultats
2-évaluer la faisabilité et la fiabilité des protocoles de PCR et des amorçes
pour l’étude de la clonalité dans les multiples catégories de tumeurs hématopoiétiques
-congrès de l’AMP (Association for Molecular Pathology) , Dallas, 2008
PCR BIOMED-2
-47 instituts européens, divisés en 7 réseaux nationaux
(Pays-Bas, Belgique, Espagne, Portugal, Royaume-Uni, Allemagne, France)
-étroite collaboration avec un comité de pathologistes
-Réseaux nationaux: collection des échantillons tissulaires
-Le comité de pathologistes: révision de tous les cas
PCR BIOMED-2
Spécimens
- 90 spécimens frais/congelés
-tumoral et réactionnel
-clonalité péalablement testée par Southern blot
-45 des 90 spécimens: tissus fixés formol et enrobés de paraffine
-tumoral et réactionnel
-testé en parallèle
-gènes des Ig (chaîne lourde IGH et chaînes légères IGK et IGL)
-gènes des TCR (chaîne TCR Bêta, TCR Gamma, TCR delta)
* chaîne TCR Alpha non-incluse dans BIOMED-2; gène très complexe
avec 54 segments V et 61 segments J
** tumeurs lymphoïdes à cellules T qui contiennent le réarrangement
TCR Alpha ont aussi le réarrangement TCR Bêta +/- TCR Gamma
-translocation t(14;18) : réarrangement IGH-BCL2
* présente dans les cas de lymphome B folliculaire (FCL)
-translocation t(11;14) : réarrangement BCL1-IGH
* présente dans les cas de lymphome B à cellules du manteau (MCL)
Sélection des cibles et développement des amorçes pour le PCR
PCR BIOMED-2
**Attention aux mutations hypersomatiques (MHS) des gènes des Ig
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%