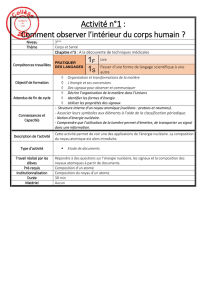
Introduction à la physique nucléaire

Physique
Physique nucléaire
3°degré
- 1 -
Introduction à la physique nucléaire
La structure de l’atome
Un atome est constitué d'un noyau central et d'un nuage électronique.
Composition du noyau
Le noyau se compose de nucléons : les protons et de neutrons ; les protons et les neutrons ont
une masse très proche l’une de l’autre, et de l’unité de masse atomique (uma). Mais le
neutron, comme son nom l’indique, ne comporte pas de charge électrique, tandis que le proton
a une charge positive, égale en valeur absolue à celle de l’électron.
Le nombre de neutrons est lié au nombre de protons : plus il y a de protons, plus il y a de
neutrons. Le rapport du nombre de protons sur le nombre de neutrons est proche de 1 pour les
éléments dont le nombre de protons est inférieur à 20. Au-delà, il y a un excédent de neutrons.
L’hydrogène, élément à proton unique, n’a pas de neutron, tandis qu’à l’opposé, l’uranium,
avec ses 92 protons, a 146 neutrons, soit un excès de 54 neutrons.

Physique
Physique nucléaire
3°degré
- 2 -
Tout donne lieu à croire que les neutrons servent de « colle » pour maintenir ensemble les
protons, chargés positivement, et qui de ce fait se repoussent à cause de la force de Coulomb.
Si des nucléons de même charge sont suffisamment proches, les forces de cohésion peuvent
compenser les forces de répulsion électrostatiques, mais en présence de nombreuses charges,
des neutrons supplémentaires semblent nécessaires.
Il n’empêche, la taille de l’édifice ne peut croître indéfiniment, et il n’y a pas d’atome stable
qui possède plus de 92 protons (et 146 neutrons).
Nomenclature
Le nombre de protons dans un noyau est noté Z, et s’appelle le numéro atomique. Il varie de 1
pour l’hydrogène, à 92 pour l’Uranium, qui est l’élément naturel qui possède le plus grand
nombre de protons.
Le nombre de neutrons se note N, et comme vu précédemment, est généralement égal ou
supérieur au nombre de protons.
La somme du nombre de protons et du nombre de neutrons, donc le nombre de nucléons se
note A, et varie de 0 pour l’hydrogène à 238 pour l’uranium 238.
Exemples
L'atome de chlore possède un noyau central contenant Z = 17 protons positifs et N = 18
neutrons. Le nombre de nucléons est donc A = Z + N = 17 + 18 = 35. On symbolise ce noyau
par .
De façon générale le noyau d'un atome correspondant à un élément X constitué de A nucléons
(Z protons et N neutrons) est noté
X
A
Z
.
La relation A = Z + N permet de calculer le nombre de neutrons présents dans le noyau.
En résumé, le noyau contient des protons positifs qui se repoussent. La cohésion du noyau est
assurée par l'interaction forte entre les nucléons.
Le nuage électronique
Outre les nucléons du noyau, l’atome possède son « cortège électronique ». Les premiers
modèles décrivaient l’atome comme un noyau central autour duquel gravitent les électrons.
Ce modèle est remplacé par le modèle du nuage électronique. Le noyau est entouré de zones
de « densité de probabilité » de trouver un électron.
Un atome, étant électriquement neutre, possédera autant d'électrons négatifs dans le nuage
électronique que de protons positifs dans le noyau.
Le diamètre d'un noyau est de l'ordre de 10 - 15 m. Le diamètre d'un atome est de l'ordre de 10 -
10 m.
L'atome de chlore possédant 17 protons positifs p + dans le noyau aura donc 17 électrons
négatifs e - répartis sur trois couches (K)2, (L)8, (M)7, loin du noyau.
REGLE :
La couche n (entier) contient au maximum 2 x n² électrons.

Physique
Physique nucléaire
3°degré
- 3 -
Couche
nombre maxi d’électrons
n = 1 (K)
n = 2 (L)
n = 3 (M)
2 x 3² = 18 électrons
Ce sont ces couches, ou orbitales électroniques qui sont responsables des propriétés chimiques
des atomes.
Un élément est donc déterminé par son nombre d’électrons, donc son nombre de protons.
Masse et énergie
La masse d’un atome est très petite. On pourrait l’exprimer selon les règles classiques, c’est à
dire en kilogrammes, mais il faudrait alors manipuler des nombres extrêmement petits. La
masse d’un atome est de l’ordre de 10-27 kg. La masse des petits atomes est, conformément à
notre attente, plus faible que celle des gros atomes. On remarque que la masse de tous les
atomes est un multiple de la masse de l’atome d’hydrogène.
Pourquoi ne pas, dès lors, prendre comme unité de masse atomique la masse de l’atome
d’hydrogène ?
C’est un peu ce que l’on a fait, si ce n’est que l’on prend comme référence le douzième de la
masse de l’atome de 12C.
L'unité de masse atomique unifiée (symbole: u, ou uma) est une unité de mesure standard,
utilisée pour mesurer la masse des atomes
Cette unité n'appartient pas au système international (SI), et sa valeur est obtenue
expérimentalement. Elle est définie comme 1/12 de la masse d'un atome de 12C (carbone), non
lié à d’autres atomes. En d'autres termes un atome de 12C a une masse de 12 uma et si on
prend N = 6,023 x 1023 atomes de 12C, on aura une masse de 12g; Une uma de 12C vaut
approximativement 1, 660 540 x 10-27kg
Pour rappel, N est le nombre d’Avogadro.
La masse atomique (ou masse molaire atomique) d'un isotope d'un élément est la masse
relative d'un atome de cet isotope par rapport à celle du carbone 12C dont la masse atomique
est fixée par convention à 12. La masse atomique est un nombre sans dimensions qui est assez
proche de la somme du nombre de protons et du nombre de neutrons dans le noyau de l'atome.
La masse atomique d’un élément chimique est la moyenne pondérée des masses atomiques de
ses différents isotopes. La masse atomique du carbone 12C est de 12,01 car il existe une infime
proportion d’isotopes 13C et 14C. Ces isotopes ont une masse atomique plus élevée que le
carbone 12C, car ils ont respectivement 1 et 2 neutrons surnuméraires.

Physique
Physique nucléaire
3°degré
- 4 -
Les noyaux atomiques sont donc constitués de protons (p) et de neutrons (n). Ces deux types
de particules, que l'on englobe sous le terme nucléons, ont presque la même masse : 1,00727
uma pour les protons, 1,00866 uma pour les neutrons.) Seuls les protons sont porteurs d'une
charge électrique (+1e). Le nombre de protons indique le numéro atomique (noté Z) de
l'élément correspondant, tandis que le nombre de masse (noté A) est égal à la somme des
protons et de neutrons. La masse atomique, quant à elle, tient compte également des électrons,
dont la masse est cependant négligeable par rapport à celle des autres nucléons ( la masse
d’un électron est environ 1836 fois plus petite que la masse d’un neutron ou d’un proton )
mais elle tient compte aussi des isotopes. Les isotopes d’un élément sont ses variantes
atomiques, qui diffèrent en général de l’élément de base par le nombre de neutrons. Pour
rappel, la masse atomique est la masse qui correspond à un douzième de la masse de 6,023 x
1023 atomes de carbone.
Nucléon
masse en uma
masse en kg
Proton
1,00727
1,67261 x 10-27
Neutron
1,00866
1,67492 x 10-27
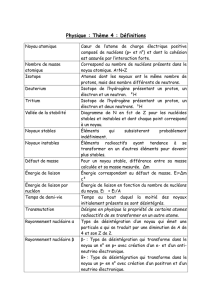
Le défaut de masse
En y regardant de plus près, étant donné les concepts ci-dessus, on peut se poser la question
suivante :
Pourquoi la masse atomique du carbone 12, par exemple, qui est de 12,01, est-elle assez
nettement inférieure à la somme des masses des nucléons ?
Ceci est bien réel : la somme des masses des nucléons individuels libres est supérieure à la
masse de ces mêmes nucléons liés au sein d’un noyau d’atome. De plus, il faudrait encore
ajouter à la masse atomique de l’atome la masse des électrons, mais celle-ci étant largement
inférieure à la masse des nucléons, on peut la négliger.
Reprenons l’exemple du carbone 12.
Les nucléons pèsent : (6 x 1,00866) + (6 x 1,00727) = 12,09558 uma.
L’atome de carbone 12 pèse, par définition, 12 uma.
0,09558 uma ont donc « disparu » lors de la constitution du noyau de carbone à partir des 6
protons et des 6 neutrons. C’est un peu comme si la masse d’un empilement de blocs de béton
était inférieure à la somme des masses de chaque bloc pris individuellement.
Cette perte de masse lors de l’assemblage de nucléons en noyaux d’atomes porte un nom :
c’est le « défaut de masse ».
On peut calculer ce défaut de masse non pas en uma, mais en kg : il est, pour l’atome de
carbone 12, de 0,09558 x 1, 660 540 x 10-27 soit 1,587 x 10-28 kg. Cela peut paraître dérisoire,
mais est à mettre en rapport avec la masse et la taille très petite des nucléons : il s’agit tout de
même d’un pratiquement un dixième d’uma pour douze nucléons.

Physique
Physique nucléaire
3°degré
- 5 -
Défaut de masse et énergie
Où est passée la masse des nucléons individuels liés lors de la constitution d’un noyau ? Tout
simplement dans l’énergie de liaison !
En effet, nous savons par la théorie de la relativité que masse et énergie sont intimement liées,
par la relation E = mc², où c représente la vitesse de la lumière dans le vide et vaut 3 x 108
m/s.
Il ne faut pas confondre cette relation avec Ep = mv2/2, du ressort de la mécanique classique !
La théorie relativiste nous apprend que la masse peut devenir énergie et vice-versa.
Le défaut de masse apparaît aussi en chimie classique, mais de manière beaucoup moins
perceptible. C’est l’importance de ce défaut de masse au niveau des nucléons qui est
responsable des grandes quantités d’énergie qui entrent en jeu dès que l’on aborde les
réactions nucléaires.
Convertissons la masse perdue en énergie, en utilisant la formule
E = mc².
Pour l’atome de Carbone 12, le défaut de masse vaut :
Masse des nucléons non liés – masse de l’atome, soit 1,587 x 10-28. C’est le cas pour un seul
atome de carbone. Mais dans un gramme de carbone, il y a (6,023 x 1023 ) / 12 atomes. Le
défaut de masse atteint dès lors 1,587 x 10-28 x (6,023 x 1023 ) / 12 soit 0,79654175 x 10-5 kg,
ou encore pratiquement 8 mg ! . Pour trouver l’énergie qui correspond à cette masse, on
multiplie par c², soit 9 x 1016. On obtient 7,16887575 x 1011 Joules !
A titre de comparaison, la combustion d’un gramme de pétrole libère une énergie E = 45
103 Joules sous forme de chaleur.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
1
/
46
100%