30 janvier 2012. support de cours /philippe

Professeur Philippe Kourilsky
Année 2011-2012
PLAN DU COURS
I. La réaction antigène - anticorps.
II.
Les récepteurs de l
’
immunité innée et la transduction des signaux
III. La reconnaissance spécifique entre deux cellules.
II.
Les
récepteurs
de
l immunité
innée
et
la
transduction
des
signaux
immunologiques depuis la surface cellulaire.
IV. L’inflammation
V. Circulation et rencontres entre cellules spécifiques
VI. La discrimination entre le soi et le non-soi.
VII. L’intégration du système immunitaire dans l’organisme.
1
30.01.2012

PROBLEMATIQUE
■
Le système immunitaire au repos est
en
mouvement
et
en alerte
PROBLEMATIQUE
■
Le
système
immunitaire
au
repos
est
en
mouvement
et
en
alerte
permanente. Surveillance incessante de l’ensemble du corps.
-
Chez l
’
homme des milliards de lymphocytes circulent de jour
-
Chez
l homme
,
des
milliards
de
lymphocytes
circulent
de
jour
comme de nuit dans le sang et la lymphe.
-
Cellules sentinelles résidentes dans les organes mais certaines sont
Cellules
sentinelles
résidentes
dans
les
organes
,
mais
certaines
sont
mobiles : en cas « d’anomalie », elles transfèrent l’information des tissus
au système circulant (ganglion drainant le plus proche).
-Cellules circulantes = cellules de l’immunité innée + lymphocytes naïfs
de l’immunité adaptive + une minorité de cellules « expérimentées »,
2
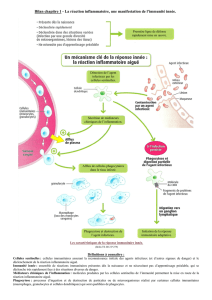
IV. L’inflammation
rapidement réactivables (dont les cellules mémoire),

■Inflammation = accumulation locale de fluide, de protéines du plasma
et de cellules blanches, provoquée par une blessure, une infection ou une
réponse immunitaire locale.
Forte composante d’immunité innée, qui n’exclut pas une participation
de l’immunité adaptative (lymphocytes).
Manifestation locale, concentrée, de phénomènes systémiques.
Occasion d’avancer dans la compréhension de l’immunité systémique.
3
IV. L’inflammation

■
Hasard et spécificité.
●Hasard des « anomalies » (infection, défaut interne) et hasard des
recrutements cellulaires
■
Hasard
et
spécificité.
recrutements
cellulaires
.
●Risques de confusion entre soi et non-soi.
●
Risques temporels importants :
●Dommages collatéraux non-spécifiques.
●
Risques
temporels
importants
:
-Délais trop longs de mise en œuvre.
-Résolution trop lente de la réaction inflammatoire.
-Liens entre inflammation chronique et cancers.
4
IV. L’inflammation

INTRODUCTION
Immunite innée Immunité adaptative
Toutes les cellules de l'organisme
Humorale (complément, etc.)
Cellulaire (macrophages,
neutrophiles)
Inflammation
Cytokines
Cellules NK, NKT, etc. DC = cellules dendritiques
Cellules T et B
Réponse humorale
(
anticorps
)
Réponse
humorale
(
anticorps
)
Réponse cellulaire (CTL etc.)
Primaire, secondaire, mémoire
5
IV. L’inflammation
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
1
/
60
100%