Exercices - La seconde 2

Physique Chimie 2
nde
: Thème : L’Univers
___________________________________________________________________________________________________________
Exercices
Exercice n°1 :
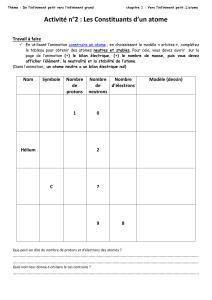
Compléter le tableau suivant en donnant le nom et la composition des atomes.
Nom Symbole Nombre de protons Nombre de neutrons Nombre d'électrons
Mg
ଵଶ
ଶସ
Au
ଽ
ଵଽ
Ti
ଶଶ
ସ଼
Cu
ଶଽ
ଷ
Ag
ସ
ଵ଼
Exercice n°2 :
Le symbole chimique de l'atome de cobalt est le suivant : Co
ଶ
ହଽ
1- Quel est le numéro atomique de l'atome de cobalt ? Qu'indique-t-il ?
2- Indiquer la structure du noyau de l'atome de cobalt
3- Calculer le nombre d'électrons qui gravitent autour du noyau
4- Calculer la charge totale des électrons
5- Calculer la masse de l'atome de cobalt
6- Calculer la masse approchée de l'atome de cobalt
Données : m
p
≈ m
n
≈ 1,67.10
-27
kg
m
e-
= 9,1.10
-31
kg
q
(e-)
= - 1,6.10
-19
C
Exercice n°3 :
Soit un atome X dont le nombre de nucléons A est le double du nombre de charge Z.
Son noyau porte une charge totale q = 19,2.10
-19
C.
1- Quel est le numéro atomique du noyau ?
2- À quel élément appartient-il ?
3- Quel est son nombre A de nucléons ?
4- Combien d'électrons comporte le cortège électronique ?
5- Quelle est la représentation symbolique de cet atome ?
Données : q
(p)
= + 1,6.10
-19
C
q
(e-)
= - 1,6.10
-19
C
Exercice n°4 :
On donne le symbole chimique de l'atome de mercure : Hg
଼
ଶଶ
1- Calculer la masse approchée d'un atome de mercure
2- Calculer la masse des électrons présents dans un atome de mercure
3- Calculer la charge électrique du nuage électronique
Données : m
p
≈ m
n
≈ 1,67.10
-27
kg
m
e-
= 9,1.10
-31
kg
q
(e-)
= - 1,6.10
-19
C
Exercice n°5 :
Un atome de carbone possède 6 protons et 12 nucléons
1- Donner sa représentation symbolique
2- Donner la composition de cet atome
3- Calculer sa masse approchée
4- Calculer le nombre d'atomes de carbone contenus dans une mine de crayon de masse m = 0,5 g
Données : m
p
≈ m
n
≈ 1,67.10
-27
kg
m
e-
= 9,1.10
-31
kg
III – Présentation de l’Univers
4- Le modèle de l'atome

Physique Chimie 2
nde
: Thème : L’Univers
___________________________________________________________________________________________________________
Exercices
Exercice n°1 :
Compléter le tableau suivant en donnant le nom et la composition des atomes.
Nom Symbole Nombre de protons Nombre de neutrons Nombre d'électrons
Magnésium
Mg
ଵଶ
ଶସ
Z = 12 donc 12 protons A = p + n = 24
donc n = 24 – 12 = 12
nombre protons =
nombre d'électrons = 12
Or
Au
ଽ
ଵଽ
Z = 79 donc 79 protons A = p + n = 197
donc n = 197 – 79 = 118
nombre protons =
nombre d'électrons = 79
Titane
Ti
ଶଶ
ସ଼
Z = 22 donc 22 protons A = p + n = 48
donc n = 48 – 22 = 26
nombre protons =
nombre d'électrons = 22
Cuivre
Cu
ଶଽ
ଷ
Z = 29 donc 29 protons A = p + n = 63
donc n = 63 – 29 = 34
nombre protons =
nombre d'électrons = 29
Ag
Ag
ସ
ଵ଼
Z = 47 donc 47 protons A = p + n = 108
donc n = 108 – 47 = 61
nombre protons =
nombre d'électrons = 47
Exercice n°2 :
Le symbole chimique de l'atome de cobalt est le suivant : Co
ଶ
ହଽ
1- Quel est le numéro atomique de l'atome de cobalt ? Qu'indique-t-il ?
Z = 27 – il indique le nombre de protons contenus dans le noyau de l'atome de cobalt
2- Indiquer la structure du noyau de l'atome de cobalt
A = 59 il correspond au nombre de nucléons (protons + neutrons)
Sachant que l'atome de cobalt contient 27 protons dans son noyau alors le nombre de neutrons est :
→
→→
→ n = A – Z = 59 – 27 = 32
3- Calculer le nombre d'électrons qui gravitent autour du noyau
Un atome est électriquement neutre il contient autant de protons que d'électrons donc l'atome de cobalt est
constitué de 27 électrons dans son nuage électronique
4- Calculer la charge totale des électrons
La charge totale des électrons est donnée par la relation suivante :
Q
nuage
= nombre d'électrons x charge de l'électron
Q
(27e-)
= q
(e-)
x 27 = 27 x (- 1,6.10
-19
) = - 4,32.10
-18
C
5- Calculer la masse de l'atome de cobalt
La masse d'un atome est donnée par la relation : m
atome
=
==
= Z x m
p
+ (A – Z) x m
n
+ Z x m
e-
Sachant que :
Le nombre de protons Z = 27 donc le nombre d'électrons est Z = 27
Le nombre de neutrons A – Z = 32
On a :
m
(Co)
= Z x m
p
+ (A – Z) x m
n
+ Z x m
e-
= 27 x m
p
+ 32 x m
n
+ 27 x m
e-
= 27 x 1,67.10
-27
+ 32 x 1,67.10
-27
+ 27 x 9,1.10
-31
= 9,85.10
-26
kg
6- Calculer la masse approchée de l'atome de cobalt
La masse des électrons est négligée :
m
(Co)
≈ 27 x m
p
+ 32 x m
n
= 9,85.10
-26
kg
Données : m
p
≈ m
n
≈ 1,67.10
-27
kg
m
e-
= 9,11.10
-31
kg
q
(e-)
= - 1,6.10
-19
C
Exercice n°3 :
Soit un atome X dont le nombre de nucléons A est le double du nombre de charge Z.
Son noyau porte une charge totale q = 19,2.10
-19
C.
1- Quel est le numéro atomique du noyau ? →
→→
→ on cherche Z donc le nombre de protons
Les protons sont les particules chargées contenus dans le noyau d'un atome
Or la charge d'un proton est q
(p)
= + 1,6.10
-19
C
Le nombre de protons est donc donné par la relation suivante : n
protons
= q
(totale)
/ q
(1proton)
= 19,2.10
-19
/ 1,6.10
-19
= 12
2- À quel élément appartient-il ?
A l'aide du tableau périodique on peut identifier l'élément magnésium
3- Quel est son nombre A de nucléons ?
Le nombre de nucléons de l'atome de magnésium est 24
III – Présentation de l’Univers
4- Le modèle de l'atome

Physique Chimie 2
nde
: Thème : L’Univers
___________________________________________________________________________________________________________
4- Combien d'électrons comporte le cortège électronique ?
Un atome est électriquement neutre donc il comporte autant de protons que d'électrons donc l'atome de
magnésium contient 12 électrons dans son nuage électronique
5- Quelle est la représentation symbolique de cet atome ? ۻ
Données : q
(p)
= + 1,6.10
-19
C
q
(e-)
= - 1,6.10
-19
C
Exercice n°4 :
On donne le symbole chimique de l'atome de mercure : Hg
଼
ଶଶ
1- Calculer la masse approchée d'un atome de mercure
m
(Hg)
≈ Z x m
p
+ (A – Z) x m
n
= 80 x m
p
+ (202 – 80) x m
n
= 3,37.10
-25
kg
2- Calculer la masse des électrons présents dans un atome de mercure
Un atome est électriquement neutre, il contient autant de protons que d'électrons donc l'atome de mercure contient
80 électrons.
m
(80e-)
= Z x m
e-
= 80 x m
e-
= 80 x 9,1.10
-31
= 7,28.10
-29
kg
3- Calculer la charge électrique du nuage électronique
q
(80e-)
= q
(e-)
x 80 = 80 x (- 1,6.10
-19
) = - 1,28.10
--17
C
Données : m
p
≈ m
n
≈ 1,67.10
-27
kg
m
e-
= 9,1.10
-31
kg
q
(e-)
= - 1,6.10
-19
C
Exercice n°5 :
Un atome de carbone possède 6 protons et 12 nucléons
1- Donner sa représentation symbolique ۱
2- Donner la composition de cet atome
Z = 6 : l'atome de carbone contient 6 protons
3- Calculer sa masse approchée
m
(C)
≈ Z x m
p
+ (A – Z) x m
n
= 6 x m
p
+ (12 – 6) x m
n
= 2.10
-26
kg
4- Calculer le nombre d'atomes de carbone contenus dans une mine de crayon de masse m = 0,5 g
m = 0,5.10
-3
kg
n
(C)
= m
mine
/ m
(C)
= 0,5.10
-3
/ 2.10
-26
= 2,5.10
22
atomes de carbone
Données : m
p
≈ m
n
≈ 1,67.10
-27
kg
m
e-
= 9,1.10
-31
kg
1
/
3
100%