Noyau atomique et radioactivité

NOYAU ATOMIQUE ET
RADIOACTIVITÉ
Explosion nucléaire dans l’atmosphère

Noyau atomique et radioactivité
Table de matière
Propriétés générales du noyau atomique ............................................................................................................... K1
Modèles atomiques ............................................................................................................................................ K1
Masse du noyau atomique ................................................................................................................................. K2
Taille du noyau .................................................................................................................................................. K3
Masse volumique du noyau ............................................................................................................................... K3
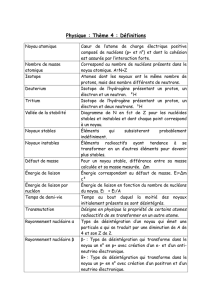
Radioactivité .......................................................................................................................................................... K4
Types de rayonnement ....................................................................................................................................... K4
Rayonnement alpha (rayonnement α) ............................................................................................................... K5
Rayonnement bêta (rayonnement ß) .................................................................................................................. K5
Rayonnement gamma (rayonnement γ) ............................................................................................................. K6
Ionisation de l'air ............................................................................................................................................... K6
Mise en évidence du rayonnement .................................................................................................................... K6
Loi fondamentale de la désintégration radioactive ............................................................................................ K8
Activité .............................................................................................................................................................. K8
Demi-vie ............................................................................................................................................................ K9
Applications des radionucléides ...................................................................................................................... K11
Datation radioactive ........................................................................................................................................ K11
Isotopes artificiels ............................................................................................................................................ K12
Liens internet ....................................................................................................................................................... K13
Formulaire ........................................................................................................................................................... K14
Recueil d’exercices .............................................................................................................................................. K15

Noyau atomique et radioactivité 13GE − 2013/14 K1
Noyau atomique et radioactivité
Propriétés générales du noyau atomique
Modèles atomiques
Les modèles atomiques sont des représentations simplifiées de la réalité
avec lesquelles on essaie de décrire les propriétés des atomes. Au fil du
temps, les modèles de la physique atomique ont pu calculer et expliquer
de manière toujours plus exacte les observations.
Démocrite a établi le premier la théorie que la matière pourrait être
constituée de particules matérielles indivisibles. Sa théorie ne s'appuyait
pas sur des expériences, mais sur la réflexion. Un point central de
l'atomisme de Démocrite était l'existence du vide, dans lequel les atomes
se déplaceraient. L'atomisme a été refusé par Platon et Aristote, parce
qu'ils considéraient l'existence du vide pour inimaginable.
Démocrite, philosophe grec du 5e
siècle avant Jésus-Christ.
Le nom atome vient du grec atomos et
signifie "indivisible".
John Dalton a démontré expérimentalement que les composés chimiques
se forment toujours dans des rapports fixes des substances individuelles.
C'est ainsi que 14 g d'azote se combinent toujours avec 16 g d'oxygène
pour former 30 g d'oxyde d'azote. L'idée était ainsi née que des composés
chimiques pourraient se former par la liaison entre eux d'atomes
individuels.
Joseph J. Thomson a découvert en 1897 pour la première fois que les
rayons jusqu'alors inconnus qui sortent d'une cathode incandescente sont
un flux de particules qui proviennent des atomes. Ces particules
s'appellent électrons. On a dû abandonner l'idée de l'indivisibilité des
atomes. Modèle atomique de Thomson (fig. 1): une masse sphérique,
chargée positivement, dans laquelle les charges négatives sont noyées. Le
modèle est également appelé modèle "plum-pudding", parce que les
charges négatives sont comme des raisins noyés dans une pâte de masse
positive.
En 1911, Ernest Rutherford a découvert en propulsant un rayonnement
radioactif de particules sur une feuille d'or (expérience de diffusion,
fig. 2) que les atomes sont constitués en grande partie de vide et que la
matière est concentrée dans le très petit noyau. La plupart des particules
du rayonnement radioactif traversaient sans encombre la feuille d'or, très
peu étaient déviées.
Modèle atomique de Rutherford (fig. 3):
! L'atome (diamètre 10–8 cm) est constitué d'une enveloppe et d'un
petit noyau massif (de manière idéalisée, ponctuel) (diamètre 10–13
cm), qui contient pratiquement toute la masse de l'atome.
! Autour du noyau chargé positivement, il existe un champ
électrique puissant; les électrons chargés négativement forment
l'enveloppe atomique.
! Le nombre de charges élémentaires positives dans le noyau
(nombre atomique) est aussi grand que le nombre d'électrons de
l'ensemble de l'atome, de sorte qu'il apparaît neutre vis-à-vis de
l'extérieur.
La charge Z du noyau atomique est un multiple entier de la charge
élémentaire e. Z correspond au numéro atomique de l'élément concerné
dans le système périodique.
En 1932, un modèle du noyau a été développé par Ivanenko et
Heisenberg. Selon ce modèle, le noyau atomique est constitué de protons
et neutrons.
John Dalton, chimiste anglais du 18e
siècle.
1. Modèle atomique de Thomson
2. Expérience de diffusion de
Rutherford
3. Modèle atomique de Rutherford
électrons
atome
particule α
particule α
feuille d'or
particule α
enveloppe
atomique
noyau

Noyau atomique et radioactivité 13GE − 2013/14 K2
Nous résumons les connaissances déjà acquises:
Le noyau atomique a la charge positive Z ⋅ e. Le nombre atomique Z
correspond au numéro atomique de l'élément chimique correspondant
dans le système périodique des éléments. La charge élémentaire e est
égale à la valeur absolue de la charge d'un électron. Le noyau atomique
est constitué de protons et neutrons. Ces constituants du noyau sont
appelés nucléons. Les noyaux atomiques de nombre de masse A sont
constitués de Z protons et N neutrons. On a: A = N + Z.
Les modèles sont très simples et ne conviennent pas pour interpréter des
affirmations plus profondes de la physique nucléaire. Pour cette raison,
Gamov a développé en 1937 le modèle de la goutte liquide (fig. 1) du
noyau atomique, que nous voulons utiliser dans la suite. Dans le modèle
de la goutte liquide, le noyau atomique est considéré comme un ensemble.
Les noyaux atomiques sont considérés comme des petites gouttes d'un
liquide nucléaire constitué de protons et neutrons. Comme les molécules
individuelles sont retenues ensemble par des forces de cohésion dans une
goutte d'eau, des forces nucléaires relient les nucléons.
Les rapports de force qui règnent dans le noyau atomique:
forces nucléaires (énergie de liaison du noyau): 1
forces électriques/de Coulomb (répulsives): 10–3
forces d'attraction gravifique (très faibles): 10–40
Masse du noyau atomique
Nucléide: Les noyaux atomiques (fig. 2) sont caractérisés par l'indication
du nombre de masse A et du nombre atomique Z sur le symbole d'élément
K.
Un nucléide est décrit par un symbole d'élément chimique, un nombre de
masse A et un nombre atomique Z.
Isotope: l'hydrogène se présente sous la forme d'un mélange d'isotopes
(fig. 3). Il est constitué à 99,986 % de l'isotope
H
1
1
, à 0,014% de
H
2
1
et à
10–10 % de
H
3
1
. L'hydrogène le plus abondant ne possède pas de neutron.
Les isotopes sont des noyaux atomiques avec le même nombre de protons
mais des nombres de neutrons différents.
L'unité de masse inclut les électrons. Ceci est uniquement possible parce
que la masse de l'électron est négligeable par rapport à la masse du noyau.
L'unité de masse atomique u est le !
!" de la masse atomique mA de
l'isotope de carbone
C
12
6
.
1 u = 1,6605 ⋅ 10-27 kg
Masse atomique relative: La masse atomique absolue mA donne la
masse d'un atome déterminé en kilogrammes. La masse atomique relative
Ar est le quotient de la masse absolue d'un atome et de la 12e partie de la
masse de l'isotope de carbone
C
12
6
.
Ar=mA
1
12 ⋅mA6
12 C
( )
1. Modèle de la goutte liquide de
Gamov
2. Désignation des noyaux atomiques
Exemple:
C
12
6
12 nucléons
6 électrons
6 protons
12 – 6 = 6 neutrons
3. Isotope: Noyaux de l'hydrogène
4. Isotope:
Noyaux de l'uranium
Deutéron
Type d'atome
Fréquence
Deutérium
Tritium

Noyau atomique et radioactivité 13GE − 2013/14 K3
Exemple: Nous calculons à partir de la masse atomique relative du
carbone (mélange d'isotopes) la masse atomique absolue.
Masse atomique relative Ar:
Isotope
A
Ar
Fréquence
C
12
6
12
12,000
98,9 %
C
13
6
13
13,003
1,1 %
C
14
6
14
14,003
3⋅10–11 %
Ar = 0,989 ⋅ 12 + 0,011 ⋅ 13,003 + 3⋅10–13 ⋅ 14,003
Ar = 12,011
La masse atomique relative du mélange d'isotopes de carbone est de
12,011.
Nous trouvons cette valeur numérique fractionnaire dans le système
périodique des éléments en dessous du carbone, bien qu'on doive à
proprement parler s'attendre à une valeur entière sur base de la définition
de l'unité de masse atomique. La cause réside dans l'existence de trois
isotopes et leur fréquence.
Masse atomique absolue mA:
mA = Ar ⋅ u
mA = 12,011 ⋅ 1,6605 ⋅ 10–27 kg
mA = 19,9 ⋅ 10–27 kg
La masse absolue de l'atome de carbone et donc du noyau (la masse de
l'électron est négligeable vis-à-vis de la masse du noyau) est de:
mA = 19,9 ⋅ 10–27 kg
Taille du noyau
Les expériences de Rutherford ont montré que la taille d’un noyau
atomique est extrêmement petite par rapport à l’atome entier. Le diamètre
du noyau mesure moins que 10–4 du diamètre de l’atome (qui, lui, vaut
quelques 10–8 cm).
Masse volumique du noyau
La densité de la matière nucléaire vaut environ 1015 kg/dm3. Ceci nous
montre les conditions particulières qui règnent dans le noyau atomique
(voir fig. 1).
Corps
Masse volumique en
g/cm3
Terre
5,55
Soleil
1,41
Sirius B
5⋅104
Pulsars
106 à 1010
Noyaux
1015
1. Masse volumique et masses
volumiques d'objets astronomiques
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
1
/
19
100%