Chap le modèle de l`atome

Physique Chimie 2nde thème : L'univers : chap : le modèle de l'atome
Chap le modèle de l'atome
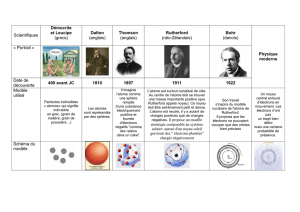
( voir activité Historique du modèle de l'atome)
I - Modèle de l'atome.
L'atome d'hydrogène est représenté ci-contre. Ces dimensions sont:
➢Diamètre du noyau: dn = 2,4.10-15m.
➢Diamètre de l'atome: da = 1,1.10-10m.
Il s'agit du plus petit atome connu. L'ordre de grandeur de leur rapport
da
dn
=105
, valable pour les petits
atomes. Ainsi la plus grande partie (volume) d'un atome est constituée de vide. C'est ce que l'on appelle une
structure lacunaire.
II- Le noyau de l'atome.
a. Les nucléons
Le noyau de l'atome est constitué de deux types de particules,
–Les protons : chargés positivement
–Les neutrons qui sont neutres
La charge électrique portée par le proton est notée e et appelée: charge élémentaire. C'est la plus petite charge
électrique stable que l'on puisse isoler.
b. Les nombres Z et A.
➢Le nombre de charge ou numéro atomique Z d'un noyau est le nombre de protons qu'il contient.
➢A représente le nombre de nucléons du noyau.
On convient de représenter le noyau d'un atome par le symbole:
Dans ce symbole, X représente un élément. Par exemple O: oxygène, Cl: chlore, N: azote.
Si l'on note N le nombre de neutrons du noyau on a : A=Z+N.
c. Les isotopes.
On appelle atomes isotopes les ensembles d'atomes caractérisés par le même numéro atomique Z et des nombres
de nucléons A différents. Ce sont donc des ensembles d'atomes qui ne diffèrent que par le nombre de leurs
neutrons.
Exemple:
C
6
12 et C
6
14
v1 chap le modele de l atome.odt

Physique Chimie 2nde thème : L'univers : chap : le modèle de l'atome
III- Le cortège électronique
a) État fondamental.
Les électrons peuvent être répartis de différentes façons dans les différentes couches. Les règles de répartitions
données ci-dessous concernent ce que nous appellerons l'atome dans son état fondamental.
b) définitions.
La couche la plus éloignée du noyau qui contient des électrons est appelée couche externe ou couche de valence.
Les électrons de cette couche externe sont appelés électrons périphériques.
c) Règles de remplissage des couches électroniques.
Première règle.
Une couche électronique ne peut contenir qu'un nombre limité d'électrons.
➢La couche K (première couche) peut contenir un maximum de 2 électrons (c'est-à-dire 0; 1 ou 2 électrons).
➢La couche L (deuxième couche) peut contenir un maximum de 8 électrons (c'est-à-dire qu'elle peut contenir
0; 1;...;7 ou 8 électrons).
➢La couche M (troisième couche) peut contenir un maximum de 8 électrons (seulement pour les éléments tels
que Z<18).
Lorsqu'une couche est pleine on dit qu'elle est saturée.
Deuxième règle.
Le remplissage des couches électroniques s'effectue en commençant par la couche K. Lorsqu'elle est saturée on
remplit la couche L et ainsi de suite.
d) Répartition ou formule électronique d'un atome ou d'un ion monoatomique.
Les règles de remplissage précédentes permettent d'établir la répartition électronique (ou formule électronique)
d'un atome ou d'un ion atomique de la façon suivante:
➢On détermine le nombre d'électrons à repartir (Z électrons pour un atome).
➢On écrit,côte à côte et entre parenthèses, les lettres de chaque couche contenant des électrons.
➢On indique, en haut et à droite de chaque parenthèse, le nombre d'électrons présents dans la couche
considérée.
Exemple:
Donner le remplissage électronique pour un atome de carbone Z=6.
Le noyau de cet atome possède donc 6 protons. Cet atome étant électriquement neutre, il possède 6 électrons qu'il
faut répartir. En utilisant les règles précédentes, on établit la formule électronique du carbone. Soit: (K)2(L)4.
IV Propriétés de l'atome.
a) Neutralité électrique (ou électroneutralité) de l'atome.
L'atome est un édifice électriquement neutre.
Le noyau comporte Z protons de charge électrique e. Sa charge électrique totale est donc: Qnoyau = Z.e
Le nuage électronique comporte Z électrons de charge électrique –e. Sa charge électrique totale est Qnuage = – Z.e.
De telle sorte que la charge électrique totale de l'atome est nulle. Qatome = 0
Z représente donc aussi le nombre d'électrons de l'atome.
b) Masse d'un atome.
Nous pouvons considérer avec une très bonne approximation que la masse de l'atome est pratiquement égale à la
masse de son noyau. La masse de l'atome X pourra donc être écrite: m(X)= Z .mproton + (A-Z).mneutron
si on considère que mproton = mneutron alors m(X) =A. mproton = A. mneutron
Exemples:
Calculer les masse de Na+ (
Na
11
23
), Ca2+ (
Ca
20
40
) , Al3+ (
Al
13
27
)
v1 chap le modele de l atome.odt
1
/
2
100%